Teksts Papildinājumu reakcijas parādīja, ka šie organisko reakciju veidi tiek nosaukti šādā veidā, jo reaģents tiek pievienots organiskajai molekulai, pārtraucot saites starp oglekļiem. Šajā tekstā tika parādīts alkēnu gadījums, šeit mēs jau apsvērsim, kā tas notiek ar alkīniem, vai tas ir, ar tiem ogļūdeņražiem (kurus veido tikai oglekļa un ūdeņraža atomi), kuriem ir saite trīskāršs.
Neaizsargātais alkīnu punkts ir tieši trīskāršā saite, kur pi (π) tipa saites var pārtraukt vienu (pievienošana daļēji) vai divreiz (kopējā pievienošana) un attiecīgi rada jaunus savienojumus ar dubultām (alkēniem) vai atsevišķām saitēm (alkāni).
Apskatīsim pievienošanās reakciju gadījumus alkīnos:
1. Ūdeņraža pievienošana vai hidrogenēšana:
Šajā gadījumā H molekula2 pievieno alkīnam, izmantojot katalizatoru, kas parasti ir niķeļa pulveris (Ni), platīns (Pt) vai pallādijs (Pd). Sakarā ar nepieciešamību izmantot katalizatoru tiek saukta arī šī reakcija katalītiskā hidrogenēšana un tas notiek pakāpeniski: pirmajā posmā jūs saņemat alkēnu, bet otrajā posmā, kas ir lēnāks, jūs saņemat alkānu.
Ja izmantotais katalizators ir spēcīgs, piemēram, niķelis un platīns, reakcijas rezultātā tieši rodas alkāns. Pallādijs sajaukts ar BaSO4 tas ir vājš katalizators un ražo alkēnu. Ir iespējams arī izmantot daļēju katalizatora inhibitoru, lai sasniegtu tikai alkēnu. Šī reakcija notiek arī zem augsta spiediena un temperatūras.
Pēc tam mums etānam pievieno ūdeņradi, iegūstot etilēnu un pēc tam etānu:

2. Halogēnu pievienošana vai halogenēšana:
Alkīna pi saite tiek pārtraukta un molekulai tiek pievienoti divi halogēna atomi (elementi no Periodiskās tabulas 17A saimes, visbiežāk izmantotie: Cl2 un Br2), veidojot vicinālu dihalīdu, kas nozīmē, ka divi halogēna atomi ir saistīti ar kaimiņu oglekļa atomiem. Reakcija var turpināties, pārtraucot otru pi saiti un pievienojot molekulai vēl divus halogēna atomus.
Tālāk sniegtajā piemērā mums ir šāda veida kukuļa papildinājumi:
ClCl ClCl
││ ││
H ─C ≡ C CH3 + Cl2 → H ─ C ═ C CH3 + Cl2 → H ─ C ─ C CH3
││
ClCl
ALCINO DI-HALETTE TETRAHALETTE
3. Ūdeņraža halogenīdu pievienošana (halogēnhidrīdi vai halogēnhidrogenēšana):
Šeit alkīnam pievieno ūdeņraža halogenīdu, un var notikt arī daļēja un pilnīga pievienošana. Svarīgs šāda veida reakcijas aspekts ir tas, ka tas seko Markovņikova valdīšana, tas ir, ūdeņradis saistās ar vairāk hidrogenētu oglekli (ar vairākiem ūdeņraža atomiem) un halogēns saistās ar mazāk hidrogenētu oglekli.
Kopējā hidrohalogenizācijā veidojas gēmisks dihalīds, tas ir, savienojums, kuram ir divi halogēna atomi, kas piestiprināti pie viena un tā paša oglekļa.
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Skatīties:
HBr Hbr
││ ││
H ─C ≡ C CH3 + HBr → H ─ C ═ C CH3 + HBr → H ─ C ─ C CH3
││
Hbr
ALCINO HALIDE GEMIC DI-HALOGIDE
Svarīgs šāda veida reakcijas piemērs ir tāds, kas rodas, pievienojot etīnam ūdeņraža hlorīdu, veidojot hloretēns vai vinilmonohlorīds, kas ir monomērs, kas veido polivinilhlorīda polimēru, labāk pazīstams ar tā saīsinājumu PVC.
HClHCl
││ ││
H ─C ≡ C - H + HCl → H ─ C ═ C - H + HCl → H ─ C ─ C - H
││
HCl
ETHINO HLOROETENE 1,1-DICHLOROETHANE
(PVC monomērs)
PVC ir viela, ko nozarē plaši izmanto dažādu produktu ražošanai, piemēram, sandales, zāļu pudeles, medicīnas ierīces, plastmasas bikses zīdaiņiem, somas, stiepļu pārklājumi, rotaļlietas, mēbeļu apdare, automašīnu apdare, lietusmēteļi, plastmasas apavi, vinila plates, grīdas, iepakojuma plēves, caurules, ko izmanto ūdensvados un notekūdeņi utt.
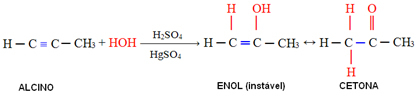
4. Ūdens pievienošana (hidratācija):
Šajā reakcijā ūdens reaģē ar alkīnu, sākotnēji veidojot enolu, kas molekulāri pārkārtojas un pārvēršas par aldehīdu (alkīnu gadījumā, kas ir mazāki par acetilēnu). Enols un aldehīds paliek dinamiskā līdzsvarā ar aldehīda pārsvaru. Šis ir gadījums Dinamiskā konstitucionālā izomērija vai tautomērija.
Piemērs:

Gadījumā, ja alkīni ir lielāki par acetilēnu, tiek ievērots Markovņikova noteikums un enols rada ketonu:
Autore Jennifer Fogaça
Beidzis ķīmiju