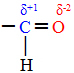Plkst starpmolekulārie spēki, vispārīgi sauc Van der Vālsa spēki, ir trīs: inducēts dipola izraisīts dipols, ūdeņraža saites un pastāvīgais dipola-pastāvīgais dipols. Šajā tekstā mēs apsvērsim tikai pēdējo no šiem trim spēkiem:
Jauda pastāvīgais dipols-pastāvīgais dipolsvai vienkārši dipols-dipols notiek tikai polārās molekulas, tas ir, tiem, kuriem nav vienmērīga slodzes sadalījuma pa tā virsmu. Kā piemēru var minēt, ka HCl molekulā (sālsūdens gāzē) elektroniskais mākonis ir vairāk pārvietots pret hlora atomu, jo tas ir vairāk elektronegatīvs nekā ūdeņradis.

Ņemiet vērā, ka ap hlora atomu notiek elektronu uzkrāšanās, kas izraisa a veidošanos negatīvs stabs, kuru simbolizē grieķu burta delta (-δ). Tā rezultātā reģionā ap ūdeņraža atomu a pozitīvs stabs (+δ), jo tam ir zems elektroniskais blīvums. HCl molekula tad veido a elektriskais dipols un tāpēc, nonākot saskarē ar citām kaimiņu HCl molekulām, starp molekulu pretējiem poliem ir pievilkšanās spēks, kā redzams zemāk:

Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
Šis pievilcīgais spēks, kas izveidojas starp vienas molekulas dipola negatīvo galu ar citas molekulas dipola pozitīvo galu, veido dipola-dipola spēku..
Tātad, kā saka nosaukums, dipols ir pastāvīgs, tāpēc tas notiek tikai polārajos savienojumos. Un jo augstāka molekulas polaritāte, jo intensīvāka ir dipola un dipola mijiedarbība vielā.
Ja tas ir cietā fāzē, pastāvīgā dipola veidošanās vada katras molekulas stāvokli kosmosā, veidojoties dipolāri kristāli; tāpat kā turpmāk aprakstītajam ūdeņraža bromīdam:

Citi polāro vielu piemēri, kuru dipola-dipola stiprums starp molekulām ir: H2S, CO, HCCl3, TIKAI2.
Šis starpmolekulārais spēks ir vidēja intensitāte, jo tas ir spēcīgāks par inducēto dipola izraisīto dipola pievilkšanās spēku, bet mazāk intensīvs nekā ūdeņraža saite. Tāpēc to kušanas un viršanas temperatūras ir augstākas nekā tām vielām, kurām ir inducēta dipola izturība. Tā kā pastāvīgais dipola spēks ir spēcīgāks, ir nepieciešams piegādāt vairāk enerģijas, lai sadalītos tā molekulu mijiedarbība.
Autore Jennifer Fogaça
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FOGAÇA, Jennifer Rocha Vargas. "Dipola-dipola starpmolekulārais spēks"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm. Piekļuve 2021. gada 27. jūnijam.
e) OS2, HBr, HCl, H2O.
c) Zinot, ka CH viršanas temperatūra3Cl un CH3Es esmu attiecīgi 24,0 ° C un 42,4 ° C, norāda, kurš savienojums šķidrajā fāzē rada intensīvākus starpmolekulāros spēkus.