Elektrolīze ir process, ko plaši izmanto ķīmiskā rūpniecība, jo tas ļauj to iegūt vielas, kas dabā nepastāv bez maksas, piemēram, hlors, jods, kaustiskā soda citi.
Elektrolīze ir pretstats šūnai, kurā elektroenerģiju iegūst, veicot redoksreakcijas, tas ir, ķīmiskā enerģija tiek pārveidota par elektrisko enerģiju. Jau tagad elektrolīzē elektrību izmanto redoksreakciju un ķīmiskās enerģijas ražošanai.
No tā izriet arī tā nosaukums elektro nozīmē "elektriskā strāva" un lizēšana nozīmē "pārtraukums". Tas notiek tieši tā, elektriskā strāva pārtrauc vai noārda tai pakļauto vielu.
Baterija ir spontāns process, tomēr elektrolīze tas nav spontāns process, kas jāuzsāk, izmantojot elektrisko strāvu.
Ir divi elektrolīzes veidi: a ugunīgs un ūdens vidē. Šajā tekstā mēs izskatīsim pirmo gadījumu.
Atšķirība starp magmatisko elektrolīzi un elektrolīzi ūdens vidē ir forma, kādā atrodas viela, kas tiks pakļauta elektriskajai strāvai. Minkveida elektrolīzes gadījumā jonu viela ir šķidrā stāvoklī, tas ir, izkausēta, bez ūdens klātbūtnes.
Vārds "ugunīgs" nāk no latīņu valodas ugunīgs, kas nozīmē "dedzināšana, iekaisums".Elektrolīzē tiek izmantots konteiners, ko sauc par a Kuba vai elektrolītiskā šūna, kur ir uzstādīti divi elektrodi, caur kuriem iet elektriskā strāva. Elektrodi var būt inerts (nemainiet elektrolīzes laikā) vai aktīvs (Elektrolīzes laikā tie tiek pakļauti zināmām izmaiņām). Visbiežāk tiek izmantoti inerti, kas izgatavoti no platīna vai grafīta.
Pēc tam elektrodi tiek savienoti ar līdzstrāvas avotu (elementu vai akumulatoru). Akumulatora negatīvais pols piegādās elektronus vienam no elektrodiem, kļūstot negatīvi uzlādēts, un piesaistīs izkausētās vielas katjonus (pozitīvos jonus). Tā kā tas piesaista katjonus, šo negatīvo elektrodu sauc par katodu. Tajā katijoni saņem elektronus un reducējas.
Pozitīvais elektrods piesaista anjonus (negatīvos jonus), un tāpēc to sauc par anodu. Anjoni izlādē savus elektronus pie anoda, veicot oksidēšanu.
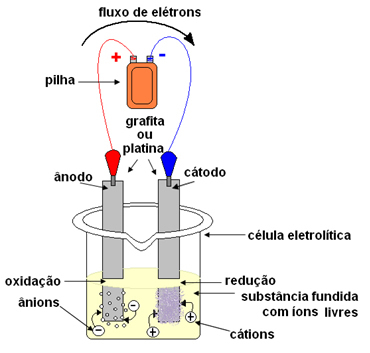
Baterijās pozitīvo elektrodu sauc par katodu, bet negatīvo - anodu. Šeit elektrolīzē tas ir pretējs, anods ir pozitīvais pols un katods ir negatīvais. Tomēr abos gadījumos akumulatorā un elektrolīzē anodā notiek oksidēšanās un katodā - reducēšanās.
Īsumā mums ir:

Vēl viens svarīgs fakts ir tas, ka šūnai vai akumulatoram, ko izmanto elektriskās strāvas ģenerēšanai, ddp (potenciāla starpībai) jābūt vienādai vai lielākai par reakcijas potenciāla starpību.
Lai labāk izprastu, kā notiek elektrolīzes process un kā tas noārda vielas, kas ražo svarīgus elementus, vai vienkāršas vielas, izlasiet tekstu Magmatiskā nātrija hlorīda elektrolīze.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/eletrolise-Ignea.htm
