Vidusskolēni vienmēr ir pakļauti saskarsmei redoksreakcijas ar joni, gan iestājeksāmenos, gan valsts vidusskolas eksāmenā (Enem). Tādējādi šo vienādojumu līdzsvarošana var būt ļoti briesmīgs priekšmets.
Lai atvieglotu šīs tēmas izpratni, šī teksta mērķis ir pievērsties redoksvienādojumu līdzsvarošana ar joniem ar dažu soļu aprakstu, lai to veiktu. Lai to panāktu, mums jāsāk ar šāda veida ķīmisko reakciju noteikšanu.
Plkst redoksreakcijas ar joniem identificē pēc viena vai vairāku komponentu klātbūtnes ar lādiņiem (pozitīviem vai negatīviem), tas ir, joni (katjoni vai anjoni), kas var būt reaģentos vai produktos, kā tas ir abos piemēros a sekot:
1. piemērs:Kr2O72- + Fe2+ + H+ → Kr3+ + Fe3+ + H2O
2. piemērs:Cl2 + C + H2O → CO2 + H+ + Cl-
Lai veiktu līdzsvarojot redoksreakciju ar joniem vienādojumus, ir svarīgi veikt dažas darbības, piemēram:
1. solis: noteikt NOX no katra reaģentu atomu un vienādojuma produktu;
2. solis: pārbaudiet, kura suga cieta oksidēšanās;
3. Solis: nosakiet NOX suga, kurai veikta oksidēšanās;
4. solis: reiziniet trešajā pakāpē atrastās variācijas ar oksidējošo sugu atomu skaitu;
5. solis: pārbaudiet, kura suga cieta samazināšana;
6. solis: noteikt NOX variācijas sugām, kurām veikta redukcija;
7. solis: reiziniet trešajā pakāpē atrastās variācijas ar to samazināto sugu atomu skaitu;
8. solis: izmantojiet ceturtajā solī atrasto vērtību kā sugas koeficientu, kas samazina;
9. solis: kā oksidējošo sugu koeficientu izmantojiet septītajā pakāpē atrasto vērtību;
10. Solis: ielieciet koeficientus citās sugās saskaņā ar metodi izmēģinājuma līdzsvarošana. Tām sugām, kur tas nav iespējams, kā koeficientus ievietojiet nezināmos;
11. solis: reiziniet katras sugas koeficientu ar tās slodzi;
12. solis: izlīdziniet reaģentu lādiņu summu ar produktu daudzumu, lai atrastu koeficientu vienai no sugām ar nezināmu;
13. solis: pabeidziet atlikumu, izmantojot izmēģinājuma metodi.
Lai atvieglotu izpratni, izpildiet iepriekš aprakstīto soli pa solim, izmantojot a redoksa vienādojums ar joniem:

Jonu vienādojums, kas parāda dažus jonus un vispārējās lādiņu grupas 0
1. solis: Katra atoma NOX.

Vienādojumā esošo atomu NOX
2. solis: Sugas, kuras tiek oksidētas.

Sugas, kurām vienādojumā notiek oksidēšanās
Tā kā joda NOX no reaģenta līdz produktam palielinās no -1 līdz 0, oksidējas tieši tā suga.
3. solis: Nosakiet oksidēto sugu NOX variācijas.
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Lai to izdarītu, vienkārši atņemiet augstāko NOX ar zemāko NOX:
∆NOX = (0) – (-1)
∆ NOX = 0 + 1
∆ NOX = 1
4. solis: NOX reizināšana ar daudzumu.
Šajā solī mēs reizinām trešajā pakāpē atrastās variācijas ar sugu atomu skaitu.
Es- = ∆NOX.1
Es- = 1.1
Es- = 1
5. solis: Sugas, kurām veic redukciju.

Sugas, kuras cieš no vienādojuma samazināšanās
Tā kā hroma NOX no reaģenta līdz produktam samazinās no +7 līdz +3, reducēšanās notiek tieši šajā sugā.
6. solis: Nosakiet samazināto sugu NOX variācijas.
Lai to izdarītu, vienkārši atņemiet augstāko NOX ar zemāko NOX:
∆NOX = (+6) – (+3)
∆ NOX = +6 – 3
∆ NOX = 3
7. solis: NOX reizināšana ar daudzumu.
Šajā solī mēs reizinām sestajā pakāpē atrastās variācijas ar sugu atomu skaitu.
Kr2O72- = ∆NOX.1
Kr2O72- = 3.2
Kr2O72- = 6
8. solis: Sāciet līdzsvarot.
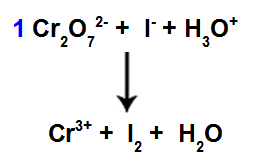
Balansēšanas sākums, izmantojot atrasto koeficientu
Šajā solī mēs sākam līdzsvarošanu, ievietojot koeficientu, kas konstatēts ceturtajā pakāpē sugām, kuras cieta samazinājumu.
9. solis: Turpiniet līdzsvarot.

Balansēšanas turpināšana, izmantojot atrasto koeficientu
10. solis: Izmantojiet izmēģinājuma metodi.
Reaģentā ir 6 I atomi, tāpēc koeficients 3 mums jāievieto I sugās2 produkta, jo tajā ir tikai 2 Cl atomi;
Tāpat kā 1. sugā, Cr2O72-, ir 2 Cr atomi, Cr sugai vajadzētu likt koeficientu 23+ produkta.
Tā kā skābeklis ir trīs sugās, un divās no tām nav koeficientu, lai turpinātu līdzsvaru, pārējās sugās mums jāievieto nezināmie:
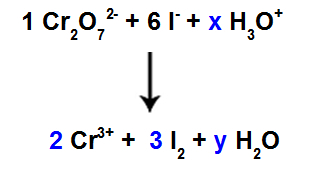
Koeficienti pēc izmēģinājuma metodes izmantošanas
11. solis: Katras sugas reizinājums ar tās slodzi.
Lai to izdarītu, vienkārši reiziniet sugas koeficientu ar tās slodzi šādi:
Reaģentos:
Kr2O72- = 1.(-2) = -2
Es- = 6.(-1) = -6
H3O+ = x. (+ 1) = + x
Uz produktiem:
Kr3+ = 2.(+3) = +6
Es2 = 4.0 = 0
H2O = y.0 = 0
12. solis: Maksu summa.
Šajā solī mums jāpievieno reaģentu un produktu daudzums, kas atrodams 11. solī:
Reaģenti = produkti
-2 + (-8) + (+ x) = +6 + 0 + 0
-2 - 6 + x = 6
-8 + x = 6
x = 6 + 8
x = 14
13. solis: Balansēšanas beigas.
Lai pabeigtu līdzsvarošanu, mums:
Ievietojiet 12. pakāpē iegūto rezultātu H sugā3O+;
Tā kā mums tagad reaģentā ir 42 H atomi, koeficients 21 ir jāievieto H sugās2Produkts.
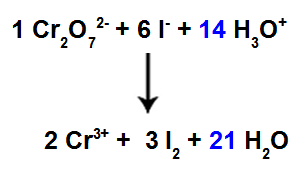
Līdzsvarots jonu reakcijas vienādojums
Autors: Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Sarkanās redukcijas reakcijas ar joniem"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-com-ions.htm. Piekļuve 2021. gada 28. jūnijam.


