Molekulu polaritāte ir ļoti svarīgs aspekts, jo vielu īpašības citu faktoru starpā nosaka fakts, ka to molekulas ir polāras vai nepolāras.
Molekulas polaritāti var noteikt, izmantojot Dipola mirklis vai Rezultāts Dipola moments, kuras simbols ir 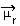 . Ja mēs runājam tikai par katras molekulas saites dipola momentu, tad simbols ir grieķu burts mi (µ).
. Ja mēs runājam tikai par katras molekulas saites dipola momentu, tad simbols ir grieķu burts mi (µ).

Molekula būs nepolāra, ja dipola moments ir vienāds ar nulli, bet, ja tas nav nulle, tas nozīmē, ka tas ir polārs.

Lai noteiktu šo iegūto dipola momentu, jāņem vērā divas svarīgas lietas. Apskatīsim, kas tie ir:
1) elektronegativitātes starpība starp reakcijā iesaistīto elementu atomiem. Piemēram, HF molekulai ir izteikta elektronegativitātes atšķirība, jo fluors saista daudz vairāk nekā ūdeņradis, elektronu pāri. Tādējādi lādiņu sadalījums nav simetrisks, ar elektriskajiem dipoliem.
Šo dipolu attēlo vektors, kas vērsts pret galu, kas koncentrē visvairāk elektronu, tas ir, no vismazāk līdz elektronegatīvākajam atomam. Tātad šajā gadījumā vektors, kas ir vienīgais, būs iegūtais vektors, kā norādīts zemāk:
Ņemiet vērā, ka vektora vērtība ir tāda pati kā dipola moments, kas norādīts debye vienībā (D = 3,33. 10-30 kulons. metro). Tā kā dipola moments nav nulle, molekula un saite ir polārs.
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
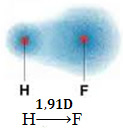
Zemāk esošajā molekulā mums ir arī molekula, kurā ir tikai divi atomi, tomēr šajā gadījumā tā atbilst vienkāršai vielai, tas ir, to veido tikai viena veida elementi. Tāpēc elektronegativitātes atšķirības nepastāv; atomi piesaista arī elektronus, kas ir simetriski sadalīti. Iegūtais dipola moments ir vienāds ar nulli, tāpēc gan saite, gan molekula ir apolārs.
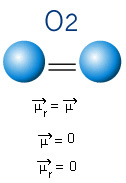
2) Molekulu ģeometrija, tas ir, vektoru telpiskais izvietojums. BF molekula3 tam ir trīs polārās saites, kurās fluors ir viselektronegatīvākais, tādējādi vektori vērsti uz to. Tomēr, tā kā atomu telpiskais izvietojums ir trīsstūris plakans, tas padara elektronus simetrisku sadalījumu ap centrālo atomu. Tādējādi rezultāts ir tāds, ka šie trīs vektori viens otru atceļ, un dipola moments ir vienāds ar nulli. Tāpēc BF molekula3 é atvainoties.
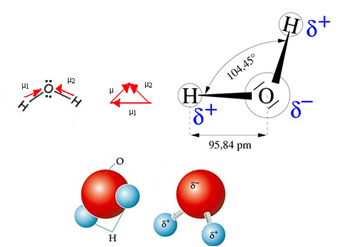
Ūdens molekulai ir divi vektori, tomēr tās telpiskā ģeometrija nav plakana, bet V formas. Nākamajā attēlā ņemiet vērā, ka tādējādi viņu vektori nenovērš viens otru, elektroni tiek sadalīti asimetriski un vairāk koncentrēti viselektronegatīvākajā atomā, kas ir skābeklis. Tādējādi dipola moments atšķiras no nulles un ūdens molekula ir polārs:
Autore Jennifer Fogaça
Beidzis ķīmiju


