Viens vienas un tās pašas izšķīdušās vielas šķīdumu sajaukšana bez ķīmiskas reakcijas tas sastāv no divu šķīdumu apvienošanas vienā traukā ar, piemēram, kālija hlorīdu (Kcl). Šāda veida maisījumos nekad nenotiks ķīmiskā reakcija vienādu izšķīdušo vielu klātbūtnes dēļ, tas ir, abiem ir vienāds katjons un viens un tas pats anjons. Tādējādi mēs varam teikt, ka, veicot maisījumu ar šīm īpašībām, mēs vienkārši pievienojam izšķīdušās vielas un šķīdinātāja daudzumu, kas veido abus šķīdumus.
Ja mēs sajauksim, piemēram, 1L ūdens un 4 gramu KI (kālija jodīda) šķīdumu ar citu 2L ūdens un 6 gramiem KI, mums būs jauns 3L ūdens un 10 gramu KI šķīdums.
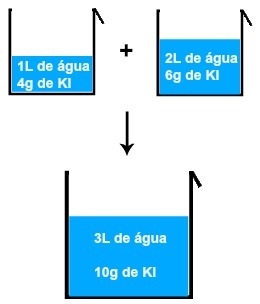
Divu kālija jodīda šķīdumu sajaukšanas rezultāts
Analizējot attēlu, mēs varam secināt izšķīdušās vielas masa (m1') pirmā šķīduma pievieno izšķīdušās vielas masai (m1'') otrā risinājuma, kā rezultātā izšķīdušās vielas masa (mF) gala šķīdumā (Mix):
m1'+ m1"= mF
Piemērā:
4 + 6 = 10 grami
Tas pats notiek ar katrā šķīdumā esošā ūdens tilpumu, tas ir, pirmā (V ') tilpums, kas pievienots otrā tilpumam (V' '), iegūst galīgo tilpumu (V'F):
V '+ V' = VF
Piemērā:
1 + 2 = 3 L
Tā kā katram šķīdumam ir izšķīdušās izšķīdušās vielas daudzums, un šeit mums ir vienas un tās pašas izšķīdušās vielas šķīdumu maisījums, tad no iepriekš minētā mēs varam noteikt katra jauktā šķīduma un arī galīgā šķīduma koncentrāciju (kopējo, molaritāti).
Tāpēc mums jāatceras formulas, lai aprēķinātu šīs koncentrācijas:
Bieži sastopama koncentrācija:
C = m1
V
m1 = izšķīdušās vielas šķīduma masa
V = šķīduma tilpums
PIEZĪME: izolējot m1 formulā mums ir: m1 = CV
Molaritāte:
M = m1
M1.V
M1 = izšķīdušās vielas molārā masa.
PIEZĪME: izolējot m1 formulā mums ir: m1 = M.M1.V
Tā kā vienas un tās pašas izšķīdušās vielas šķīdumu maisījums attiecas uz šķīduma izšķīdušās vielas masas summu, katru novērojumu varam aizstāt ar šādu izteicienu:
m1'+ m1'' = mF
C '. V' + C '. V' '= CF.VF
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
C '= 1. šķīduma kopējā koncentrācija
C '' = 2. šķīduma kopējā koncentrācija
Ja šķīdumu maisījuma aprēķins ietver molaritāti:
m1'+ m1"= mF
M'.V '+ M'. V '' = MF.VF
PIEZĪME: Tā kā izšķīdušā viela ir vienāda, molārā masa katrā šķīdumā ir vienāda; tāpēc aprēķinā tas tiek atstāts novārtā.
tagad redz piemēri, kas aptver aprēķinus vienas un tās pašas izšķīdušās vielas šķīdumu maisījumā bez ķīmiskas reakcijas:
1. piemērs: (Mackenzie-SP-Adaptada) Pievienojot 600 ml 14g / L KOH šķīduma noteiktam tilpumam (v) 84 g / l tās pašas bāzes šķīduma, iegūst 67,2g / L šķīdumu. Pievienotā 84 g / L šķīduma tilpums (v) ir:
a) 0100 ml
b) 3000 ml
c) 2700 ml
d) 1500 ml
e) 1900 ml
Vingrinājumā sniegtie dati bija:
V '= 600 ml
C '= 14 g / l
V '' =?
C '= 84 g / l
VF = ?
CF = 67,2 g / l
Pirms 1. šķīduma pievienotā tilpuma noteikšanas mums sākotnēji jānosaka galīgais tilpums, izmantojot šādu izteicienu:
V '+ V' = VF
600 + V "= VF
Aizstājot vērtības, kas norādītas zemāk esošajā matemātiskajā izteiksmē, mums ir:
C '. V' + C '. V' '= CF.VF
14. 600 + 84.V "= 67.2. (600 + V" ")
8400 + 84.V "= 67.2. 600 + 67,2 V "
8400 + 84 V "= 40320 + 67,2 V"
84. V "- 67.2. V" = 40320 - 8400
16.8.V '' = 31920
V '' = 31920
16,8
V '= 1900 ml
2. piemērs: (UFOP) 1000 ml mērkolbā pievienoja 250 ml 2M sērskābes šķīduma ar 300 ml 1M šīs pašas skābes šķīduma un tilpumu uzpildīja līdz 1000 ml ar destilētu ūdeni. Nosaka iegūtā šķīduma molaritāti.
Vingrinājumā sniegtie dati bija:
V '= 250 ml
M '= 2 M
V '= 300 ml
M '' = 1 M
VF = 1000ml
MF = ?
Lai noteiktu galīgā šķīduma molaritāti, izmantojiet procesu matemātisko izteiksmi:
M'.V '+ M'. V '' = MF.VF
2. 250 + 1. 300 = MF.1000
500 + 300 = MF. 1000
800 = MF
1000
MF = 0,8 mol / l
Autors: Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Vienas un tās pašas izšķīdušās vielas šķīdumu maisījums bez ķīmiskas reakcijas"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/mistura-solucoes-mesmo-soluto-sem-reacao-quimica.htm. Piekļuve 2021. gada 27. jūnijam.



