Hidrogenēšana notiek ar nepiesātinātiem acikliskiem ogļūdeņražiem, tas ir, kuriem ir atvērtas ķēdes ar dubultām vai trīskāršām saitēm, piemēram, alkēniem, alkīniem un dieniem. Tas var notikt arī aromātiskajos ogļūdeņražos, jo tiem gredzenā ir dubultās saites un ar ciklāniem (cikloalkāniem) līdz pieciem oglekļiem.
Šie savienojumi karsējot reaģē kā ūdeņradis dažu katalizatoru, piemēram, niķeļa, platīna un palādija klātbūtnē. Tādējādi notiek pievienošanās reakcija, kurā pi (π) saite tiek pārtraukta, veidojot divas jaunas viencaites un molekulā tiek ievadīts ūdeņradis.
Parasti mums ir:
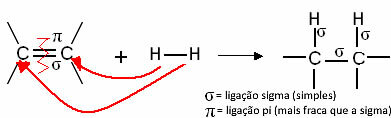
Vispārēja hidrogenēšanas reakcija
Tagad aplūkosim dažus piemērus:
- Hidrogenēšana līdz alkēniem: Iegūtais produkts ir alkāns.
Zemāk mums ir etilēna (vai etilēna) hidrogenēšanas reakcija, lai iegūtu etānu:
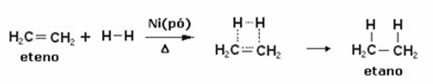
Etilēna hidrogenēšanas reakcijas piemērs
Šāda veida katalītisko hidrogenēšanu pārtikas rūpniecība izmanto, lai iegūtu puscietus taukus, piemēram, margarīni. Augu eļļas un tauki atšķiras tikai ar to, ka eļļām ir garas molekulas ar divkāršām saitēm starp ogļiem, bet taukiem starp tām ir tikai atsevišķas saites ogles.
Tādējādi, lai eļļu pārvērstu taukos, pietiek ar eļļas hidrogenēšanu. Tādā veidā jūsu dubultās obligācijas tiks sadalītas un pārvērstas par atsevišķām obligācijām. Rezultāts ir zvanu ražošana hidrogenēti augu tauki.
- Alkyne hidrogenēšana: Tā kā alkīniem ir divas pi saites, to pilnīga hidrogenēšana notiek divos posmos, pirmajā veidojas alkēns, bet otrajā - alkāns.
Zemāk redzamajā reakcijā mums ir propīna hidrogenēšana ar propāna galīgo veidošanos:
1. solis: H3C C ≡ CH + H2 → H3C CH═ ÇH2
2. posms: H3C CH═ ÇH2 + 2 stundas2 → H3C CH2─ ÇH3
Ja mēs vēlamies, lai šī reakcija apstātos 1. solī, mums jāizmanto kāda viela, kas pārtrauc katalizatora darbību.
- Dienu hidrogenēšana: Ir trīs veidu dieni: uzkrājies (dubultās saites parādās zemāk), izolēts (dubultās saites atdala vismaz divas atsevišķas saites) un konjugāti (pārmaiņus parādās dubultās saites).
Uzkrāto un izolēto diēnu hidrogenēšana notiek tāpat kā mēs redzējām alkēnus, bet dubultā, jo dienās ir vairāk nepiesātināto. Skatiet divus piemērus:
* Hidrogenēšanas piemērs uzkrātajā dienē:
H H H
│ │ │
H3C CH ═ Ç ═ CH CH3 + 2 stundas2 → H3C CH ─ Ç ─ CH CH3
│ │ │
H H H
* Hidrogenēšanas piemērs izolētā dienē:
H H H H
│ │ │ │
H3C CH ═ CH─CH2 CH ═ CH CH3 +2 H2 → H3C CH ─ CH─CH2 CH ─ CH CH3
No otras puses, konjugēto diēnu hidrogenēšana var notikt divos veidos: ar 1,2 un 1,4 pievienošanu. Visizplatītākais ir 1,2 pievienojums, kurā ogļūdeņražiem, kas veido dubulto saiti, pievieno zemūdens ūdeņražus. Savukārt 1,4 pievienojums notiek paaugstinātā temperatūrā, un tas notiek tad, kad 1. un 4. ogleklī ir rezonanse un parādās brīvās valences. Skatiet katra gadījuma piemērus:
* 1.2 pievienošanas piemērs konjugētos dienos:
H2C CH CH ═ CH2 + H2 → H2C CH ─ C ─ CH ═ CH2
│ │
H H
* 1.4. Pievienošanas piemērs konjugētos dienos:
H2C CH CH ═ CH2 + H2 → H2C CH ═ CH CH2
│ │
H H
- Aromātisko līdzekļu hidrogenēšana: Benzola gredzena pi saites tiek sadalītas, un ogļūdeņražiem, kas veido šīs saites, pievieno ūdeņraža atomus.
Šis kopējās hidrogenēšanas veids ir parādīts zemāk:

Kopējā benzola hidrogenēšanas reakcija
- Ciklāna hidrogenēšana: Notiek alkāna veidošanās.
Piemērs: ciklopropāna hidrogenēšana:
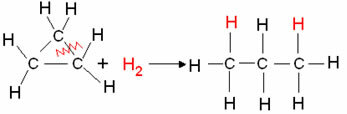
Ciklopropāna hidrogenēšanas reakcija
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/reacao-organica-hidrogenacao.htm
