Fermenti ir bioloģiskie katalizatori, kas ir atbildīgi par noteiktas ķīmiskās reakcijas ātruma palielināšanu. Fermenti parasti ir olbaltumvielas, bet ir daži ribonukleīnskābes kas darbojas kā fermenti, tos sauc par ribozīmiem.
Lai paātrinātu reakciju, fermentiem jāpiesaistās reaģentiem, kurus sauc par substrātiem. Ilgu laiku tika uzskatīts, ka šī saite ir diezgan stingra, modeli, kas pazīstams kā atslēga. pašlaik, Tomēr tiek pieņemts modelis, kas pazīstams kā inducēts savienojums., kas pieņem, ka fermenta formā notiek nelielas izmaiņas, substrātam nonākot aktīvajā vietā.
Lasiet arī: Kas ir vielmaiņa?
Kas ir fermenti?
Fermenti ir biomolekulas, kas darbojas kā katalizatori, tas ir, tie ir vielas, kas spēj paātrināt ātrumu ķīmiskās reakcijas kas rodas dzīvās būtnēs, bet netiek patērētas šo reakciju laikā. Bez fermentu darbības dažas reakcijas būtu ļoti lēnas, kas kaitētu metabolismam. Fermenti selektīvi paātrina reakcijas un tāpēc ir ļoti specifiski katalizatori.
Fermenti spēj paātrināt reakciju, samazinot aktivācijas enerģiju, tas ir, tie samazina enerģijas daudzumu, kas jāpievieno, lai sāktos reakcija.
[publikācija_omnia]
Vai katrs ferments ir olbaltumviela?
Lai gan tos bieži definē kā proteīna rakstura bioloģiskos katalizatorus, ne katrs ferments ir olbaltumviela. Ir dažas RNS, kas darbojas kā fermenti, ko sauc par ribozīmiem. Lielākā daļa enzīmu tomēr ir olbaltumvielas, tāpēc tos veido aminoskābes. Šo biomolekulu aminoskābju sastāvs nosaka trīsdimensiju struktūru, ko tā iegūs.
Lasiet arī: Kā darbojas katalizējošās vielas?
Fermentu-substrātu komplekss
To sauc par reaģenta substrātu, uz kuru iedarbojas ferments. Kad ferments saistās ar tā substrātu, komplekss veidojas ferments-substrāts. Šī saistīšana notiek noteiktā reģionā, ko sauc par aktīvo vietni.
Kad mēs runājam par fermentiem, kuru pamatā ir olbaltumvielas, aktīvā vieta atbilst tikai dažām aminoskābēm, un atlikusī molekula ir atbildīga par aktīvās vietas konfigurācijas noteikšanu. Aktīvās vietas forma, kā arī substrāta forma ir saistīta ar fermenta specifiku, jo tām jābūt savstarpēji papildinošām.
Atslēgu slēdzenes modelis
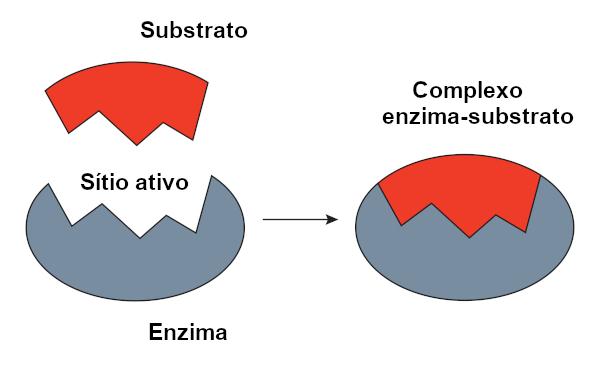
O atslēgu slēdzenes modelis, ko ierosināja Emīls Fišers, plaši izmanto, lai izskaidrotu mijiedarbību starp fermentu un substrātu. Saskaņā ar šo modeli starp fermentu un substrātu pastāv stingra komplementaritāte, tāpat kā atslēga un slēdzene. Fermenta aktīvajai vietai būtu papildu forma substrātam, kas lieliski iederētos. Tāpēc citām molekulām nebūtu piekļuves šai vietai, kas garantētu fermenta specifiku. Tāpat kā atslēga atver tikai slēdzeni, ferments saistās tikai ar substrātu. Tomēr šodien mēs zinām, ka tas modelis nav pareizs, jo fermenti nav stingras struktūras, kā tika domāts iepriekš.
Inducēts montāžas modelis
Pašlaik vispieņemtākais modelis, lai izskaidrotu saikni starp fermentu un tā substrātu ir viens no snap izraisīts, ko sākotnēji ierosināja Koshland et al. Aktīvā vietne un substrāts nedarbojas stingri kā atslēga un slēdzene. Pētījumi rāda, ka, substrātam nonākot aktīvajā vietā, fermentā notiek nelielas modifikācijas, kas veicina piemērotību starp aktīvo vietu un substrātu. Lai labāk izprastu šo modeli, mēs varam iedomāties fermentu un substrātu mijiedarbību kā rokasspiedienu, kas pēc pirmā kontakta kļūst stingrāka.
Kofaktori
Lielākajai daļai enzīmu katalītiskās darbības veikšanai ir nepieciešamas palīgmolekulas, ko sauc par kofaktoriem. Kofaktori var būt pastāvīgi piesaistīti fermentam vai arī vāji un atgriezeniski piestiprināti pie pamatnes. Viņi arī var būt neorganisks vai organisks. Kad kofaktori ir organiskas molekulas, tos sauc koenzīmi.
Daži vitamīni darbojas kā koenzīmi, piemēram, attiecībā uz riboflavīnu, kas pazīstams arī kā B2 vitamīns. Kā neorganisko kofaktoru piemērus mēs varam minēt dzelzi un cinku to jonu formā.
Lasiet arī: B kompleksa vitamīni - vitamīnu grupa, kas parasti darbojas kā koenzīmi
Fermentu klasifikācija
Fermentus var iedalīt sešas grupas, kā kritēriju izmantojot reakcijas veidu, ko tie katalizē.
Oksidoreduktāzes: fermenti, kas saistīti ar oksīrssamazināšana.
Transferāzes: katalizē grupu pāreju no viena savienojuma uz otru.
Hidrolāzes: katalizē hidrolīzes reakcijas.
Noslēpumi: rīkojieties, pievienojot grupas divkāršajām saitēm vai noņemot grupas, kas veido dubulto saiti.
Izomerāzes: katalizē izomerizācijas reakcijas.
Saites: fermenti, kas izraisa noārdīšanās molekulu ATP, izmantojot šajā reakcijā izdalīto enerģiju jaunu savienojumu veidošanai.
Faktori, kas regulē fermentu aktivitāti
Fermenta darbību ietekmē faktori, no kuriem galvenie ir temperatūra un pH. Temperatūrai parasti ir pozitīva loma ķīmiskajās reakcijās, palielinot fermentatīvās reakcijas ātrumu. Tomēr, kad temperatūra palielinās virs optimālajiem apstākļiem, reakcijas ātrums ievērojami samazinās. Tas ir tāpēc, ka tiek novērota olbaltumvielu denaturācija. Lielākajai daļai cilvēka enzīmu optimālā temperatūra ir no 35 līdz 40 ° C. Papildus temperatūrai, pH tas ietekmē arī fermentatīvo aktivitāti, un ir arī optimāla vērtība. Lielākajai daļai enzīmu optimālā pH vērtība ir robežās no 6 līdz 8.
Autore Vanesa Sardinha dos Santos
Bioloģijas skolotājs

