Jūs amfoteriskie oksīdi tie ir oksīdi, kuriem ir neskaidra uzvedība, jo pret skābi tie izturas kā bāzes oksīdi; un bāzes klātbūtnē viņi izturas kā skābie oksīdi.
Gan bāzei, gan skābei, ar kuru reaģē amfoteriskie oksīdi, jābūt stiprām, ar ļoti izteiktu ķīmisko raksturu.
Amfoteriskie oksīdi parasti ir jonu cietvielas, slikti šķīst ūdenī, un, reaģējot ar šīm spēcīgajām skābēm un bāzēm, tie ražo ūdeni un sāli.
Vispārīgi runājot, mums ir:
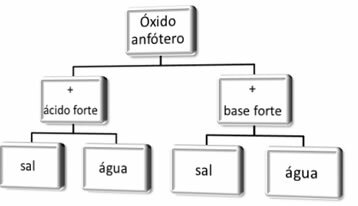
Amfoterisko oksīdu reakcijas shēma.
Šīs ir reakcijas, kurās iesaistīti divi amfoteriskie oksīdi, cinka oksīds (ZnO) un alumīnija oksīds (Al2O3). Ievērojiet, kā noteiktās situācijās viņi reaģē kā skābes, bet citās - kā bāzes:
1. gadījums: reaģējot ar spēcīgām skābēm: izturēties kā pamata oksīdi, veidojot sāli un ūdeni
Oksīda skābes sālsūdens
spēcīgs amfoterisks
(bāze)
ZnOs) + H2TIKAI4 (aq) → ZnSO4 (aq) + H2O(1)
Al2O3 (s) + 6 HCl(šeit) → 2 AlCl3 (aq) + 3 H2O(1)
2. gadījums: reaģējot ar spēcīgām bāzēm: izturēties kā skābie oksīdi, veidojot sāli un ūdeni
Oksīda bāzes sālsūdens
spēcīgs amfoterisks
(skābe)
ZnOs) + 2NaOH(šeit) → In2ZnO2 (aq) + H2O(1)
Al2O3 (s) + 2 KOH(šeit) → 2 KAlO2 (aq) + H2O(1)
Galvenie amfoteriskie oksīdi ir cinks un alumīnijs; ieskaitot cinka oksīdu (ZnO), kas pazīstams arī kā alvaid, ir balts, amorfs, bez smaržas pulveris, kas nešķīst ūdenī, bet šķīst skābos šķīdumos un ko izmanto klaunu seju krāsošanai. To lieto arī kā savelkošu un sauļošanās līdzekli losjonu, ziedes un želatīna formā.

Klauns, uzklājot balinātāju (cinka oksīdu) kā grimu
Ir arī citu metālu oksīdi (SnO un SnO2, PbO un PbO2) un nemetāliem (As2O3, Plkst2O5, sēdēja2O3, sēdēja2O3).
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/oxidos-anfoteros.htm