Kā paskaidrots tekstā Risinājumi Piesātinājums, ķīmiskos šķīdumus veido, izšķīdinot a izšķīdis uz šķīdinātājs. Katrai izšķīdušai vielai ir šķīdības koeficients specifisks, kas ir maksimālais izšķīdušās vielas daudzums, kas izšķīst noteiktā šķīdinātāja daudzumā noteiktā daudzumā temperatūra.
Grafika ar šķīdības līkni uzbūve
Piemēram, šķīdības koeficients KNO3 ir 31,2 g 100 g ūdens 20 ° C temperatūrā. Ja mēs tieši tādu kālija nitrāta daudzumu izšķīdinām 100 g ūdens 20 ° C temperatūrā, piesātināts šķīdums. Jebkurš šī sāls papildu daudzums izgulsnējas (tvertnē veido dibena ķermeni).

Tomēr šķīdības koeficients mainās atkarībā no temperatūras. Tātad, ja mēs sildām šo piesātināto šķīdumu ar KNO apakšējo daļu3, nogulsnes pakāpeniski izšķīst ūdenī. Skatīt zemāk KNO šķīdības koeficientu vērtības3 100 g ūdens dažādās temperatūrās:
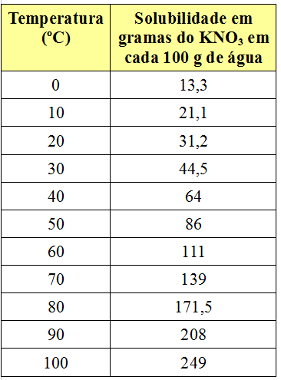
Ņemiet vērā, ka šķīdība šī sāls daudzums ūdenī palielinās, paaugstinoties temperatūrai. Lielākajā daļā vielu tas tā arī ir. Ja mēs šīs vērtības ievietosim a grafisks, mums būs šādas iespējas:
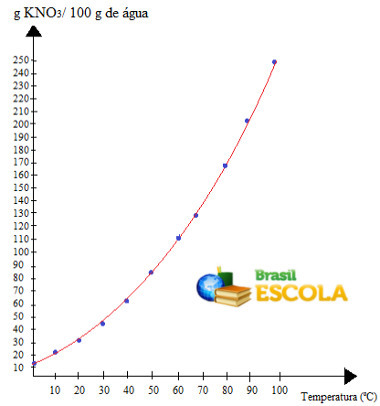
tas ir aicinājums šķīdības līkne KNO3. Mēs sakām, ka tas ir augšupejošs, jo aug, pieaugot temperatūrai.
Izšķīdušo vielu šķīdības līkņu raksturojums grafikā
Katrai vielai ir savs šķīdības līkne dotajam šķīdinātājam. Dažām no šīm vielām ir samazināta šķīdība, paaugstinoties temperatūrai, kā tas ir CaCrO gadījumā4, kas ir šķīdības līkne uz leju. Tas nozīmē, ka, sildot piesātinātu šī sāls šķīdumu, daļa izšķīdušā sāls izgulsnējas.
Kas attiecas uz citām vielām, temperatūras paaugstināšanās tik daudz netraucē šķīdībā, kā tas notiek ar galda sāls (NaCl) šķīdumu. Pie 20 ° C NaCl šķīdības koeficients ir 36 g 100 g ūdens, bet, ja mēs paaugstinām temperatūru līdz 100 ° C, šī šķīdība tikai palielināsies līdz 39,8 g, kas ir ļoti mazs pieaugums.
Ir arī vielas, kurās šķīdība palielinās tikai līdz noteiktam temperatūras paaugstināšanās punktam, jo pēc tam šķīdība samazinās. Tas notiek, piemēram, ar hidratētām vielām, kuras, karsējot, nonāk dehidrēšanas laikā. Tāpēc mainoties tā sastāvam, mainās arī tā šķīdības variācijas ar temperatūru. Šo parādību var novērot diagrammā, izmantojot šķīstamības līknes locījumus.
Zemāk mēs piedāvājam a grafiks ar šķīdības līknēm dažādu vielu:
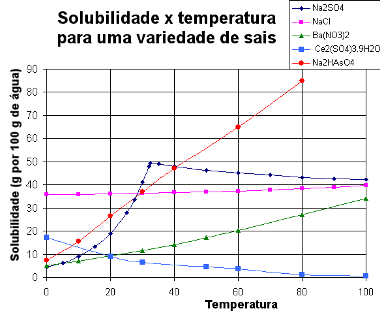
Dažādu sāļu šķīdības līknes
Izmantojot šāda veida grafiku, mēs varam salīdzināt dažādu sāļu šķīdību vienā šķīdinātājā un tajā pašā temperatūrā.
Šķīduma klasifikācija, izmantojot grafiku ar šķīdības līkni
Plkst šķīdības līknes tie arī palīdz noteikt šķīdumu piesātinājumu, tas ir, vai tie ir nepiesātināti, piesātināti, fona piesātināti vai pārsātināti. Skatiet piemēru:
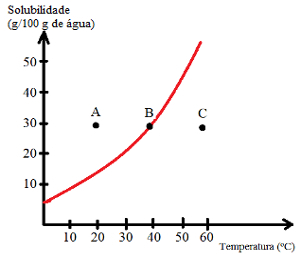
Skatiet, kādus risinājumu veidus norāda punkti A, B un C:
A: Piesātināts ar ķermeņa apakšdaļu. A punktā 30 g izšķīdušās vielas izšķīdina 100 g ūdens 20 ° C temperatūrā. Līkne parāda, ka šajā brīdī šķīdības koeficients ir aptuveni 15 g / 100 g ūdens. Tādējādi, tā kā izšķīdušās vielas daudzums ir lielāks, tiek iegūts piesātināts šķīdums ar ķermeņa dibenu.
B: Piesātināts. B punkts atrodas tieši uz šķīdības līknes, kas norāda, ka šķīdums ir piesātināts, jo 40 ° C temperatūrā 100 g ūdens ir izšķīdināts 30 g izšķīdušās vielas. Tad tas ir tieši šīs izšķīdušās vielas šķīdības koeficients šajā temperatūrā.
C: nepiesātināts. Ir 30 g izšķīdušās vielas, kas izšķīdināta 100 g ūdens 60 ° C temperatūrā. Līkne parāda, ka šajā brīdī šķīdības koeficients ir lielāks par 50 g / 100 g ūdens. Tādējādi, tā kā izšķīdušās izšķīdušās vielas daudzums ir mazāks par šķīdības koeficientu, ir nepiesātināts šķīdums.
Tādējādi mēs varam secināt, ka:
Punkti virs līknes: piesātināti šķīdumi ar fona ķermeni;
Līknes punkti: piesātināti šķīdumi;
Punkti zem līknes: nepiesātināti šķīdumi.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/graficos-das-curvas-solubilidade.htm

