Katalizatora darbība galvenokārt ir paredzēta, lai paātrinātu noteiktas reakcijas attīstību. Tas ir iespējams, jo katalizators maina reakcijas norises mehānismu, kas noved pie “alternatīva ceļa”, kas prasa mazāk aktivācijas enerģijas, lai reakcija sāktos un sasniegtu aktivēto kompleksu.
Ir vairāki katalīzes veidi, no kuriem viens ir neviendabīga katalīze, kuru var definēt kā tas, kas notiek, ja sistēmai ir vairāk nekā viena fāze, tas ir, reaģenti un produkti ir tādā stāvoklī, kas atšķiras no katalizatora fiziskā stāvokļa.
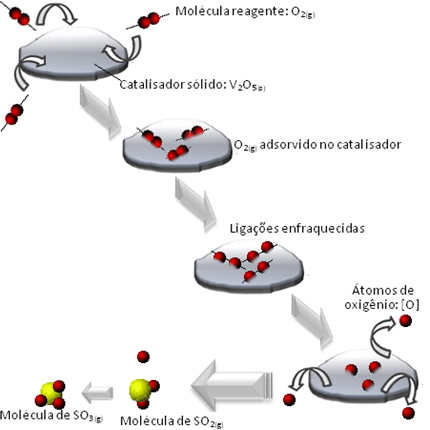
Piemērs, ko mēs varam pieminēt, ir sērskābes veidošanās starpposms (H2TIKAI4 (aq)). Šis solis sastāv no sēra trioksīda (SO3. punkta g) apakšpunkts) sēra dioksīda (SO2. punkta g) apakšpunkts):
2 SO2. punkta g) apakšpunkts + O2. punkta g) apakšpunkts → 2 OS3. punkta g) apakšpunkts
Tā kā šī reakcija norit tik lēni, tās paātrināšanai tiek izmantots katalizators. Katalizators, ko šajā gadījumā var izmantot, ir divanādija pentoksīds (V2O5 (S)), kas ir ciets. Tā kā reaģenti un reakcijas produkti ir gāzveida, mums būs neviendabīga sistēma.
Bet kā divanādija pentoksīds var paātrināt reakciju?
Notiek tas, ka skābekļa reaģenta molekulas tiek adsorbētas, tas ir, saglabājas uz divānādija pentoksīda virsmas. Tas laika gaitā vājina šīs gāzes molekulu saites, kas atvieglo kompleksa veidošanos aktivizējas un līdz ar to samazina reakcijas aktivācijas enerģiju, palielinot tās attīstības ātrumu, tas ir, tās ātrums.
Kā tas notiek, skatiet zemāk redzamajā diagrammā:
Citi heterogēnas katalīzes piemēri ir parādīti zemāk. Ņemiet vērā, ka abos gadījumos reaģenti un produkti ir gāzveida, ūdens vai šķidrā stāvoklī, bet katalizatori ir cietā stāvoklī:
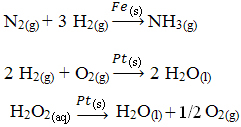
Heterogēnas katalīzes, kas notiek mūsu ikdienā, piemērs ir pārveidotāji automašīnas katalītiskais, labāk pazīstams kā katalizatori. Šīs pretpiesārņošanas ierīces ir pārklātas ar vielām, kas darbojas kā katalizatori parasti palādija un rodija sakausējums (benzīna dzinējiem) un pallādija un molibdēna (benzīna dzinējiem) sakausējums. alkohols).
Šajā katalizatorā notiek ķīmiskas reakcijas, kurās nepilnīgas sadedzināšanas gāzes, kas ir vairāk kaitīgas cilvēkiem, tiek pārveidotas par netoksiskām gāzēm. Reaģenti un produkti ir visas gāzes, turpretī katalizatori ir cietas vielas.
Lai uzzinātu vairāk par šīs iekārtas operētājsistēmu, izlasiet tekstu: "Katalizators”.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/catalise-heterogenea.htm