
Kaloriju daudzums ir atkarīgs no ēdiena uzbūves. Tātad, lai eksperimentāli noteiktu ēdiena izdalīto siltuma daudzumu, ko ķermenis var absorbēt, mēs izmantojam ierīci ar nosaukumu kalorimetrs.
Šī ierīce mēra siltumu, ko atbrīvo ēdiens, to sadedzinot. Ir vairāki kalorimetru veidi; pirmo no tiem 1780. gadā izveidoja Lavoizjē un Laplass, un tas bija a ledus kalorimetrs.
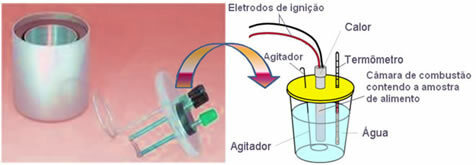
Mūsdienās visbiežāk tiek izmantots un tiek ņemts vērā iepriekš paskaidrotais kaloriju jēdziens ūdens kalorimetrs. Šī ierīce ir pārklāta ar izolācijas materiālu, lai novērstu siltuma zudumus no barotnes; un analizējamo pārtiku ievieto sadegšanas kamera, kas satur skābekļa gāzi un elektrodi. Šie elektrodi iziet elektrisko izlādi un izraisa to aizdegšanos un pārtikas sadedzināšanu.
Zināmā ūdens masa, kas atrodas kalorimetrā, absorbē sadedzinātā ēdiena izdalīto siltumu un a termometrs mēra ūdens temperatūras paaugstināšanos. Turklāt kalorimetrs satur a maisītājs kas ļauj ūdens temperatūrai palikt vienveidīgai visā tās garumā.
Tātad, ja mēs izmantojam, piemēram, 1 grama cukura masu un kalorimetrā ir 1000 g ūdens, un mēs to novērojam beigās reakcijas rezultātā ūdens temperatūra no 20 ° C līdz 24 ° C, tas ir, tā palielinājās par 4 ° C, tad mēs varam sasniegt cukurs. Patīk? Nu, ņemot vērā sākotnējo kaloriju koncepciju, mums ir:
| Paaugstiniet no 1 ° C → 1 cal uz gramu ūdens |
| Paaugstināt no 4 ° C → 4 cal uz gramu ūdens |
Tātad 1 g ūdens absorbē 4 kaļķus. Tomēr tika izmantoti 1000 g ūdens, un, ņemot vērā, ka tas absorbēja visu sadegšanā izdalīto siltumu, kopējā ūdens absorbētā enerģija bija 4000 cal jeb 4 kcal. Tāpēc mēs secinām, ka:
| Cukura enerģētiskā vērtība = 4000 cal / g vai 4 kcal / g. |
Pārveidošana uz SI:
1 kcal 4,18 kJ
4 kcal / g x
x = 16,72 kJ / g
Turklāt, lai aprēķinātu atmestā vai absorbētā ūdens siltuma daudzumu, mēs varam izmantot šādu vienādojumu:
| Q = m. ç. t |
Kur:
Q = siltums, ko atdod vai absorbē ūdens;
m = ūdens masa;
c = īpatnējais ūdens siltums, kas ir vienāds ar 1,0 cal / g. ° C vai 4,18 J / g. ° C;
Δt = temperatūras svārstības, kuras cieta ūdens, ko dod galīgās temperatūras pazemināšanās ar sākotnējo (tf - ti).
Izmantojot šo formulu, mēs iegūstam to pašu rezultātu:
Q = m. ç. t
Q = 1000 g. 1,0 kal / g. ° C. (24-20) ° C
Q = 4000 kal
Q = 4,0 kcal
vai
Q = m. ç. t
Q = 1000 g. 4,18 kJ / g. ° C. (24-20) ° C
Q = 16,72 kJ
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/medindo-as-calorias-dos-alimentos-por-meio-um-calorimetro.htm
