Vienu no lielākajiem izaicinājumiem ikvienam, kurš apgūst ķīmiju, sauc par elektronisko izplatīšanu. Tas, ko mēs šajā kontekstā piedāvāsim, var ievērojami atvieglot jūsu pētījumus saistībā ar zinātnieka Linusa Paulinga piedāvāto elektronu konfigurāciju.
Maksimālais elektronu skaits, kas ietilpst katrā slānī vai enerģijas līmenī, ir norādīts tabulā:
Enerģijas līmeņa slānis Maksimālais elektronu skaits
1. K 2
2. L 8
3. M 18
4. N 32
5 ° O 32
6. P 18
7. Q 8
Apakšlīmeņu enerģijas pieaugošā secība ir secība pa diagonālēm. Linus Pauling diagramma ir parādīta zemāk:
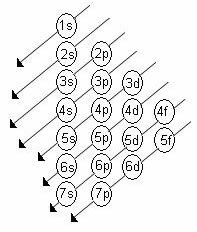
Pamatnoteikumi:
1. Elementa atomskaitlis (Z) neitrālā stāvoklī norāda sadalāmo elektronu skaitu. Šis skaitlis ir attēlots elementa simbola apakšējā kreisajā daļā.
2. Izmantojot Paulinga diagrammu, sāciet sadalīt elektronus no augšas uz leju, ņemot vērā pieaugošo enerģijas kārtību (kas vērsta uz bultiņu virziena).
3. Aizpildiet apakšlīmeņus ar maksimālo elektronu līmeni. Ja noteiktā apakšlīmenī ir tikai 6 elektroni, nepārsniedziet šo daudzumu.
4. Pārbaudiet elektronu skaitu, saskaitot tos katrā apakšlīmenī.
Īstenosim to praksē?
Izplatiet dzelzs atoma elektronus (Z = 26).
Ja atomu skaitlis ir 26, tas nozīmē, ka parastajā dzelzs atomā ir 26 elektroni. Piemērojot Paulinga diagrammu, mums būs:

Autore Líria Alves
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm
