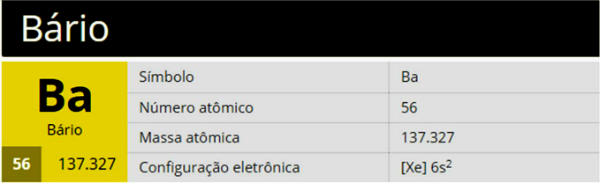
Bārijs ir ķīmiskais elements ar simbolu Ba, atomu skaitli 56 un atomu masu 137 327, kas pieder periodiskās tabulas 2. grupai (2.A saime), kas ir sārmzemju metāls.
Tās nosaukums cēlies no grieķu valodas barys un tas nozīmē smagu.
Iespējas
Istabas temperatūrā tas ir cietā stāvoklī, ar mīkstu konsistenci un sudrabainu krāsu. Tomēr dabā tas nav atrodams tīrā veidā, jo, saskaroties ar gaisu, tas viegli oksidējas.
Bārijs ir sastopams barīta rūdās (BaSO4) un viterītu (BaCO3). Galvenās šo rūdu ieguves vietas atrodas Lielbritānijā, Itālijā, Čehijas Republikā, ASV un Vācijā.
Bārijam ir augstas kušanas temperatūras (1000 K - 727 ° C) un viršanas temperatūra (2170 K - 1897 ° C). Tas joprojām ir labs elektrības vadītājs.
Saskarē ar ūdeni un alkoholu tas ir ļoti reaktīvs. Tā reakcija ar ūdeni rada hidroksīdu un izdalās ūdeņradis.
Šķīstošie bārija savienojumi ir toksiski organismam. Neskatoties uz to, ka to satur ūdenī un pārtikā, esošā bārija daudzums nav pietiekams, lai izraisītu veselības problēmas.
Pateicoties tā augstajai oksidēšanas jaudai, bārijs ir jāsaglabā minerāleļļā.
Uzziniet vairāk, lasiet arī:
- Ķīmiskie elementi
- Periodiskā tabula
lietojumprogrammas
Starp galvenajiem bārija pielietojumiem ir iekļauti:
- Tīrā veidā to izmanto skābekļa noņemšanai no elektroniskajiem vārstiem;
- Žurku inde bārija karbonāta formā;
- Izmanto kā baltu pigmentu krāsās;
- Stikla ražošana;
- Bārija sulfātu izmanto kā šķidrumu naftas un gāzes urbumu urbšanai;
- Bārija hlorātu un nitrātu izmanto zaļās liesmas ražošanā pirotehniskajos uzliesmojumos;
- Bārija sulfīds uzlabo kontrastu gremošanas sistēmas rentgena pārbaudēm un tiek ievadīts pacientiem iekšķīgi. Norīšana nerada veselības problēmas, jo viela nešķīst, neuzkrājas un ātri izdalās no organisma;
Kaut arī bārija sulfīds ir nekaitīgs, bārija karbonāts ir ārkārtīgi toksisks un var izraisīt letālu iznākumu. Personai ar intoksikāciju ir apgrūtināta elpošana, vemšana, trīce, tahikardija, paaugstināts asinsspiediens un siekalošanās.
Jūs varētu interesēt arī:
- Metāla saites
- Varš
- Litijs



