mums ir šķīdumu sajaukšana ar dažādām izšķīdušām vielām bez ķīmiskas reakcijas kad divi vai vairāki maisījumi, kuriem ir kopīgas vielas ar vienu un to pašu jonu (vai nu to pašu katjonu, vai to pašu anjonu). Tāpat kā šajā piemērā:
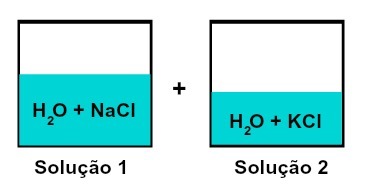
Šķīdumu maisījums, kam ir dažādas izšķīdušās vielas
1. šķīdums ir ūdens un nātrija hlorīds (NaCl), bet 2. šķīdumā ir ūdens un kālija hlorīds (KCl). Sajaucot kopā, mums ir: dažādu izšķīdušo šķīdumu sajaukšana bez ķīmiskas reakcijas, jo abiem izmantotajiem sāļiem ir hlorīda anjons (C.l-).
1. Dažādu izšķīdušo šķīdumu bez ķīmiskas reakcijas maisījumu raksturojums
Ja tiek veikts tādu šķīdumu maisījums, kuriem ir dažādas izšķīdušās vielas bez ķīmiskas reakcijas, vienmēr pārbauda zemāk norādītās īpašības:
Katras izšķīdušās vielas masa nemainās (ja 1. šķīdumā mums ir 10 g izšķīdušās vielas un, piemēram, 2, 30 g, pēc sajaukšanas mums būs vienāda katras izšķīdušās vielas masa),
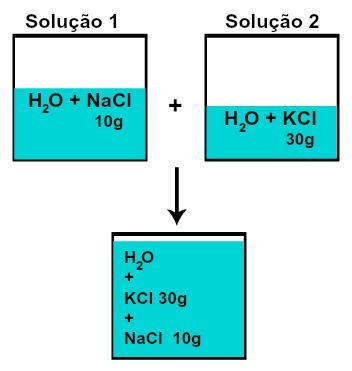
Katras izšķīdušās vielas masa pēc šķīdumu sajaukšanas bez ķīmiskas reakcijas
vielas daudzums n) katra no izšķīdušajām vielām nemainās (ja 1. šķīdumā mums ir 5 mol izšķīdušās vielas un, piemēram, 2, 4 mol, pēc sajaukšanas mums būs vienāds daudzums katras vielas),
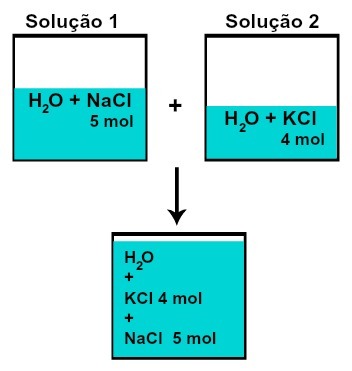
Katras izšķīdušās vielas molu skaits pēc šķīdumu sajaukšanas bez ķīmiskas reakcijas
Galīgā šķīduma tilpums, VF, ir katra jauktā šķīduma tilpuma summas rezultāts (ja 1. šķīdumā mums ir 200 ml un 2. šķīdumā, piemēram, 300 ml, pēc sajaukšanas mums būs 500 ml tilpuma),
VF = V1 + V2
2- Formulas, ko izmanto dažādu izšķīdušo vielu sajaukšanas aprēķinos bez ķīmiskas reakcijas.
Tāpat kā šāda veida maisījumos mums ir tikai palielinājies šķīdinātāja daudzums attiecībā pret katru no šiem izšķīdušās vielas, mums jāaprēķina katra izšķīdušās vielas galīgā koncentrācija, izmantojot sekojošo izteicieni:
a) uz kopēja koncentrēšanās (Ç)
1. šķīdumam: 1. šķīduma koncentrācijas reizinājums ar tilpumu ir vienāds ar galīgo koncentrāciju, kas reizināta ar tā tilpumu
Ç1.V1 = CF.VF
2. šķīdumam: 2. šķīduma koncentrācijas reizinājums ar tā tilpumu ir vienāds ar galīgo koncentrāciju, kas reizināta ar tā tilpumu
Ç2.V2 = CF.VF
b) uz koncentrācija vielas daudzumā vai molaritāte (M)
1. risinājumam:
M1.V1 = MF.VF
2. risinājumam:
M2.V2 = MF.VF
c) Katra šķīdumā esošā jona koncentrācija vielas daudzumā
Ja mums jānosaka viena vai visu gala šķīdumā esošo jonu koncentrācija, mums:
1º: Atcerieties, ka jonu koncentrāciju izsaka, izšķīdušās vielas, no kuras tā nāk, koncentrācijas (M) reizināšanas ar tās indeksu vielas formulā. Tātad jonam Y 1. vielā XY3, koncentrācija būs:
[Y]1 = 3. M
Attiecībā uz izšķīdušo vielu 2, ZY, Y koncentrāciju nosaka:
[Y]2 = 1. M
2º: Ja mums ir vairāk nekā viena izšķīdušā viela, kas atbrīvo to pašu jonu, piemēram, XY izšķīdušās vielas3 un ZY, kuriem ir vienāds jons Y, šī jona koncentrāciju gala šķīdumā izsaka tā koncentrāciju summa katrai izšķīdušai vielai:
[Y]F = [Y]1 + [Y]2
3- Aprēķinu piemēri, kas saistīti ar dažādu izšķīdušo vielu šķīdumu sajaukšanu bez ķīmiskas reakcijas
1. piemērs: (PUC SP) Vārglāzē tika sajaukti 200 ml kalcija hlorīda (CaCl) ūdens šķīduma2) ar 0,5 mol koncentrāciju. L–1 un 300 ml 0,8 mol šķīduma. L–1 nātrija hlorīda (NaCl). Iegūtā šķīduma hlorīda anjonu koncentrācija ir aptuveni:
a) 0,34 mol. L–1
b) 0,65 mol. L–1
c) 0,68 mol. L–1
d) 0,88 mol. L–1
e) 1,3 mol. L–1
Vingrinājumā sniegtie dati bija:
1. risinājums:
Skaļums (V1): 200 ml
Molārā koncentrācija (M1): 0,5 mol. L–1
2. risinājums:
Skaļums (V2): 300 ml
Molārā koncentrācija (M2): 0,8 mol. L–1
Lai noteiktu hlorīda anjonu koncentrāciju (Cl-), mums ir jāveic šādas darbības:
1. darbība: aprēķina galīgā šķīduma tilpumu
VF = V1 + V2
VF = 200 + 300
VF = 500 ml
2. darbība: Aprēķina galīgā šķīduma molāro koncentrāciju attiecībā pret izšķīdušo CaCl2, izmantojot zemāk esošo izteicienu:
M1.V1 = MF.VF
0,5 200 = MF.500
100 = MF.500
100 = MF
500
MF = 0,2 mol. L–1
3. solis: Aprēķiniet hlorīda molāro koncentrāciju [Cl-]1, gala šķīdumā no CaCl izšķīdušās vielas2, izmantojot zemāk esošo izteicienu:
PIEZĪME: Šajā formulā molaritāte tiek reizināta ar 2, jo Cl ir indekss 2 izšķīdušās vielas formulā CaCl2.
[Cl-]1 = 2.MF
[Cl-]1 = 2. 0,2
[Cl-]1 = 0,4 mol. L–1
4. solis: Aprēķina galīgā šķīduma molāro koncentrāciju attiecībā pret izšķīdušo NaCl, izmantojot šādu izteicienu:
M2.V2 = MF.VF
0,8,300 = MF.500
240 = MF.500
240 = MF
500
MF = 0,48 mol. L–1
5. darbība: Aprēķiniet hlorīda molāro koncentrāciju, [Cl-]2, galīgajā šķīdumā no izšķīdinātas NaCl, izmantojot šādu izteicienu:
PIEZĪME: Šajā formulā molaritāte reizināta ar 1, jo Cl ir indekss 1 izšķīdušās NaCl formulā.
[Cl-]2 = 1.MF
[Cl-]2 = 1. 0,48
[Cl-]2 = 0,48 mol. L–1
6. solis: Aprēķiniet kopējo hlorīda jonu daudzumu gala šķīdumā
Lai to izdarītu, vienkārši pievienojiet hlorīdu molāro koncentrāciju katram no izšķīdušajiem 3. un 5. solī:
[Cl-]F = [Cl-]1+ [Cl-]2
[Cl-]F = 0,4 + 0,48
[Cl-]F = 0,88 mol. L–1
2. piemērs: 500 ml 6 mol / l KOH šķīdumam pievienoja 300 ml K šķīduma.2TIKAI3 3 mol / l. Kāda ir katra izšķīdušās vielas koncentrācija iegūtajā maisījumā
a) 3,75 un 3,0 mol / l
b) 3,75 un 1,215 mol / l
c) 4,5 un 1,125 mol / l
d) 3,75 un 1,125 mol / l
e) 4,5 un 1,215 mol / L
Vingrinājumā sniegtie dati bija:
1. risinājums:
Skaļums (V1): 500 ml
Molārā koncentrācija (M1): 6 mol. L–1
2. risinājums:
Skaļums (V2): 300 ml
Molārā koncentrācija (M2): 3 mol. L–1
Lai noteiktu hlorīda anjonu koncentrāciju (Cl-), mums ir jāveic šādas darbības:
1. darbība: aprēķina galīgā šķīduma tilpumu
VF = V1 + V2
VF = 500 + 300
VF = 800 ml
2. darbība: Aprēķina galīgā šķīduma molāro koncentrāciju attiecībā pret KOH izšķīdušo vielu, izmantojot šādu izteicienu:
M1.V1 = MF.VF
6500 = MF.800
3000 = MF.800
3000 = MF
800
MF = 3,75 mol. L–1
3. solis: Aprēķina galīgā šķīduma molāro koncentrāciju attiecībā pret izšķīdušo K2TIKAI3, izmantojot zemāk esošo izteicienu:
M2.V2 = MF.VF
3300 = MF.800
900 = MF.800
900 = MF
800
MF = 1,125 mol. L–1
Autors: Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/mistura-solucoes-com-solutos-diferentes-sem-reacao-quimica.htm

