Dissociācija bāzes tas ir fiziskais process kas notiek ar šo svarīgo neorganisko vielu grupu, kad tās izšķīdina ūdenī, vai kad viņi iziet kodolsintēzes procesu (pāreja no cietā stāvokļa uz šķidro stāvokli caur apkure).
Kopumā parādība bāzes disociācija tas ir katjonu un anjonu atbrīvošana, kas veido jonu savienojums, kas šajā gadījumā ir pamats. Tātad, laikā bāzes disociācija, atbrīvošana joni kas jau pastāv savienojumā, tas ir, neveidojas jauni joni.
Bāzi veido jebkurš metāls (X), kas ir savienojuma katjons, vai amonija katijons (NH grupa4+), kas savienots ar hidroksīda anjonu (ko apzīmē OH grupa), kā parādīts zemāk:
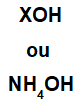
Bāzes formulas vispārīgi attēlojumi
forma pārstāvēt bāzes disociācija to veic, izmantojot vienādojumu, kurā reaģentā mums ir bāze, un produktos ir joni (katjoni un anjoni). Atšķirība ir tā, kā notiek disociācija:
Bāzes šķīdināšana ūdenī:
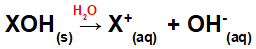
Vienādojums, kas attēlo bāzes disociāciju ūdens vidē
Atslēgšanās no bāzes apvienošanās:
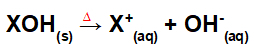
Vienādojums, kas attēlo bāzes disociāciju kodolsintēzes procesā
Analizējot iepriekš minētos vispārīgos vienādojumus, mēs pārbaudām, vai visos no tiem vienmēr būs bāze, katjons (kas ir metāla vai NH grupa4+) un anjonu (OH-). Bet vai viņi visi ir tādi? Vai starp viņiem nav atšķirības? Uz pirmo jautājumu atbilde ir nē, bet uz otro jautājumu - jā.
Kad mēs veicam norobežošanās no bāzes, vispirms ir būtiski analizēt bāzes formulu, jo no tās mēs varam noteikt katjonu un hidroksīda anjonu mol daudzumu, jo katjonu mol daudzums ir standarts (vienmēr 1 mol).
Ir vērts atcerēties, ka OH formās esošo OH grupu daudzums nosaka katjona lādiņu un hidroksīda anjona daudzumu molā bāzes disociācijā.
Apskatīsim alumīnija hidroksīda piemērus [Al (OH)3] un zelta hidroksīds (AuOH). Alumīnija bāzes formulā ir trīs OH grupas, bet zelta bāzes formulā - tikai viena OH grupa. Tādējādi, nošķirot šīs bāzes, mums ir:
Al (OH) disociācija3:
Tā kā šai bāzei formulā ir trīs OH grupas, katjona lādiņš būs +3, un anjonu daudzums molos ir vienāds ar 3 mol, kā redzams šādā vienādojumā:
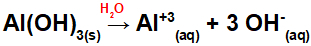
Alumīnija bāzes disociācijas vienādojums ūdens vidē
Atdalīšanās no AuOH:
Tā kā šai bāzei formulā ir OH grupa, katjona lādiņš būs +1, un anjonu daudzums molos ir vienāds ar 1 mol, kā redzams šādā vienādojumā:
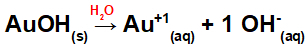
Bāzes disociācijas vienādojums ar zeltu ūdens vidē
Autors: Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-dissociacao-das-bases.htm

