Šķīdums ir divu vai vairāku vielu homogēns maisījums.. Kā, piemēram, sāls (izšķīdušās vielas) šķīdums, kas izšķīdināts ūdenī (šķīdinātājā).

Īpaši ķīmiskajās laboratorijās un rūpniecībā šis process ir ļoti svarīgs, jo ķīmiķim jāsagatavo šķīdumi ar zināmu koncentrāciju. Turklāt eksperimentālās darbībās tiek izmantoti šķīdumi ar ļoti zemu koncentrāciju, tāpēc koncentrētā šķīduma paraugu atšķaida līdz vēlamajai koncentrācijai.
Ikdienā vairākas reizes, pat nemanot, mēs veicam šķīdumu atšķaidīšanas procesu. Piemēram, uz tīrīšanas un sadzīves higiēnas līdzekļu, piemēram, dezinfekcijas līdzekļu, iesaiņojuma ieteicams tos pirms lietošanas atšķaidīt. Daži ražotāji uz produktu etiķetēm iesaka to atšķaidīt ar ūdeni proporcijā no 1 līdz 3, tas ir, katrai produkta daļai jāpievieno 3 daļas ūdens. Tas tiek darīts, jo produkts ir ļoti koncentrēts un stiprs, un, ja tas nav atšķaidīts pareizi, tas var sabojāt vietu, kur tas tiks uzklāts. No otras puses, ja to atšķaidīsit vairāk nekā vajadzētu, varat zaudēt naudu, jo produkts nesasniegs vēlamo rezultātu.

Cits piemērs ir tas, kad mēs gatavojam sulas. Daudzu sulu koncentrātu etiķetes norāda, ka glāze sulas jāatšķaida vai jāsajauc ar 5 glāzēm ūdens. Tādējādi sula ir “vājāka”, tas ir, mazāk koncentrēta.
Iedomājieties, ka esat atšķaidījis šādu sulu 3 L ūdens. Ja sākotnējā sulas koncentrācija bija 40 g / l, tas nozīmē, ka tā masa bija 40 g uz katru litru šķīdinātāja. Bet, tā kā mums būs 3 L, masa tiks dalīta ar 3, un koncentrācija pēc tam būs aptuveni 13, 33 g / l vai 13 grami uz katru litru šķīduma. Tomēr visā šķīdumā joprojām saglabājas 40 g izšķīdušās vielas masa.
Šo jauno koncentrāciju var aprēķināt šādi:
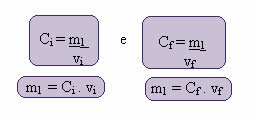
Ja indeksi i un f attiecīgi norāda sākotnējo un galīgo vērtību. Tā kā m1 vērtība nav mainījusies, mēs varam izlīdzināt vienādojumus:
Çi. vi = Cf. vf
Saskaņā ar iepriekšējo piemēru esošo vērtību aizstāšana:
Sākotnējais risinājums:
Çi: 40g / l
m1: 40g
vi: 1L
Galīgais risinājums:
Çf: ?
m1: 40g
vf: 3L
Çi. vi = Cf. vf
(40 g / l). (1 L) = Cf. 3L
Çf = 40 g / l
3
Çf = 13,333 g / l
Tas pats pamatojums attiecas arī uz molāro koncentrāciju (M) un izšķīdušās vielas vai titra masas procentiem (T):
Mi. vi = Mf. vf un Ti. vi = Tf. vf
Autore Jennifer Fogaça
Beidzis ķīmiju
Brazīlijas skolu komanda
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/diluicao-solucoes.htm
