difūzija un izsvīdums ir divi likumi, ko 19. gadsimtā ierosināja skotu ķīmiķis Tomass Greiems, pamatojoties uz viņa pētījumiem par gāzes maisījumi un uzvedība gāzes ejot cauri konteinera sienām.
Starp Thomas Graham novērojumiem par gāzu uzvedību saistībā ar difūziju un izsvīdumu mēs varam izcelt sekojošo:
Gāzei vienmēr ir tendence iziet cauri maziem caurumiem, kas atrodas cietvielu vielās;
Jo lielāks molekulas masa gāze, jo grūtāk iziet cauri cietās vielas caurumiem;
Jo mazāks ir gāzes blīvums, jo lielāks ir tā kustības ātrums;
Jo augstāka temperatūra tiek pakļauta gāzei, jo lielāks ir ātrums, kādā tā izplatās vidē vai iziet caur atveri;
- Gāze noteiktā vietā nekad nepaliek statiska.
Difūzija
Difūzija tā ir fiziska parādība, kas sastāv no gāzes spējas izkliedēties (tas ir, izplatīties) visā laukuma telpā vai konteinera iekšpusē. Šī iemesla dēļ mēs varam teikt, ka telpā gāze nekad neaprobežojas tikai ar vienu vietu.

Pārraides rašanās attēlojums
Turklāt mēs varam definēt difūzija tā joprojām ir jauda, kas vienai gāzei jāsajauc ar citu, ja to ievieto tajā pašā traukā, veidojot viendabīgu gāzveida maisījumu.
Piemērs ir gadījumi, kad gāzes rodas no transportlīdzekļa izplūdes gāzēm. Lai cik toksiski tie būtu, tie īslaicīgi nenodara kaitējumu cilvēkiem, jo tie izplatās visā atmosfēras gaisā, tādējādi samazinot to koncentrāciju.
Izsvīdums
Izsvīdums tā ir fiziska parādība, kas sastāv no gāzes iziešanas caur caurumiem, kas atrodas noteikta konteinera sienās, tas ir, gāzes izejā no vienas vides uz otru.

Izliešanas parādīšanās
Piemērs ir gadījums, kad baloni tiek uzpūsti ballītei un nākamajā dienā tie visi tiek iztukšoti, un tas viss notiek gaisa dēļ, kas izplūst caur gaisa balonos esošajām caurumiem.
Aprēķini, kas saistīti ar difūziju un izsvīdumu
Saskaņā ar Greiema piedāvātajiem vienādojumiem mēs varam aprēķināt gāzes darbības ātrumu difūzija vai izsvīdums. Pēc Grehema teiktā, divu traukā sajauktu gāzu difūzijas un izplūdes ātrumi ir vienmēr ir apgriezti proporcionāls to relatīvā blīvuma vai molārās masas kvadrātam.
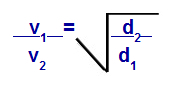
Grehema likums attiecībā uz blīvumu
v1 = gāzes 1 ātrums (izsvīdums vai difūzija) maisījumā;
v2 = gāzes 2 ātrums (izsvīdums vai difūzija) maisījumā;
d1 = maisījuma gāzes blīvums 1;
d2 = maisījuma gāzes 2 blīvums;
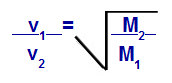
Grehema likums par molāro masu
v1 = gāzes 1 ātrums (izsvīdums vai difūzija) maisījumā;
v2 = gāzes 2 ātrums (izsvīdums vai difūzija) maisījumā;
M1 = maisījuma gāzes molārā masa 1;
M2 = gāzes molārā masa maisījumā.
Autors: Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm

