Hibridizācija ir nosaukums, kas dots nepilnīgu atomu orbitālu saplūšanai vai savienošanai, parādība, kas palielina kovalentās saites ko atoms var izdarīt. Atceroties, ka orbitāle ir atoma reģions, kurā ir lielāka varbūtība atrast elektronu.
Zināt atomu izveidoto saišu skaitu un izprast parādību hibridizācija, ir jāzina daži pamatjautājumi par atomu:
1O punkts: enerģijas apakšlīmenis
Enerģijas apakšlīmeņi, kas var būt atomam, ir s, p, d, f.
2O punkts: orbitāļu skaits vienā apakšlīmenī
Katram enerģijas apakšlīmenim ir atšķirīgs orbitāļu daudzums, kā mēs redzam tālāk:
Apakšlīmenis s: 1 orbīta;
p apakšlīmenis: 3 orbitāles;
D apakšlīmenis: 5 orbitāles.
Šo orbitāļu vispārīgais attēlojums tiek veikts šādi:
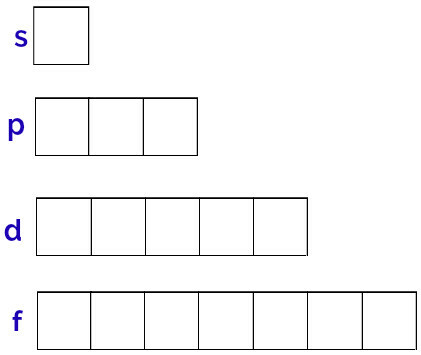
Katra apakšlīmeņa orbitālu attēlojums
Pēc Pauli domām, orbitālē var būt ne vairāk kā 2 elektroni ar griežas (rotējošas kustības) pretī.
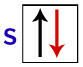
S orbitāles attēlojums ar tās elektroniem
Pēc Hunda teiktā, apakšlīmeņa orbitāle saņem savu otro elektronu tikai tad, kad visas pārējās šīs apakšlīmeņa orbitāles jau ir saņēmušas pirmo elektronu.
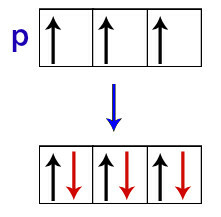
Elektronu sadalījums p apakšlīmeņa orbitālēs
3O punkts: elektroniska izplatīšana
Lai saprastu hibridizāciju un atomu radīto saišu skaitu, ir svarīgi veikt elektroniskais sadalījums uz Linus Pauling diagrammas.

Linusa Paulinga diagramma
Atceroties, ka maksimālais elektronu skaits katrā apakšlīmenī ir:
s = 2 elektroni;
p = 6 elektroni;
d = 10 elektroni;
f = 14 elektroni.
Pēc šī īsā pārskata mēs varam noteikt tagad kas ir hibridizācija. Šim nolūkam mēs izmantosim ķīmisko elementu boru (atomu skaitlis = 5) kā piemēru.
Veicot elektronisko bora izplatīšanu, mums ir:
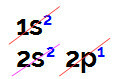
Elektroniskais bora sadalījums Linus Pauling diagrammā
Šajā sadalījumā ir iespējams novērot, ka bora s apakšlīmenī ir 2 elektroni un p apakšlīmenī - 1 elektrons. valences slānis.
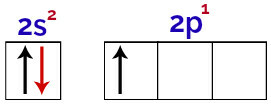
Elektroni bora valences slāņa orbitālēs
Tā kā boram ir 1 nepilnīga orbitāle, tāpēc tam vajadzētu izveidot tikai vienu kovalento saiti, jo saišu skaits vienmēr ir tieši saistīts ar nepilnīgu orbitāļu skaitu.
Tādējādi, kad bora atoms saņem enerģiju no ārējās vides, tā elektroni, īpaši tie, kas atrodas valences apvalkā, kļūst satraukti. Tas liek vienam no s orbitāles elektroniem aiziet un aizņemt vienu no tukšajām p orbitālēm, tādējādi iegūstot 3 nepilnīgas atomu orbitāles, kā redzat nākamajā attēlā:

Bora atoma ierosinātā stāvokļa attēlojums
Visbeidzot, pastāv nepilnīgas s orbitāles savienojums ar nepilnīgajām orbitālēm. Šo savienību sauc hibridizācija. Tā kā mums ir s orbitāles saplūšana ar diviem p, to sauc hibridizācija sp2.
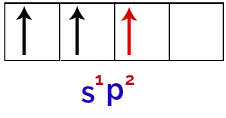
Hibridizēto orbitāļu attēlojums bora atomā
Papildus boram hibridizācijas parādība notiek vairākos citos ķīmiskajos elementos, piemēram, sērs (S), ksenons (Xe), fosfors (P), ogleklis (Ç), berilijs (Esi).
Autors: Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-hibridizacao.htm

