auto-oksi samazināšana vai nesamērīga reakcija ir redoksreakcijas veids, kurā notiek viens un tas pats ķīmiskais elements oksidēšanās un samazināšana. Apskatīsim divus šāda veida reakciju piemērus un to līdzsvarošanu, izmantojot redoksa metodi:
1. piemērs:
PIE2- + H+ → NĒ3- + NĒ + H2O
- Aprēķinot visu reakcijā iesaistīto atomu un jonu oksidācijas skaitļus (NOX), ir iespējams pārbaudīt, kas oksidējās un kas reaģēja:
+3 -2 +1 +5 -2 +2 -2 +1 -2
PIE2- + H+ → NĒ3- + NĒ + H2O
- Ņemiet vērā, ka slāpeklis bija suga, kas reaģēja un oksidējās:
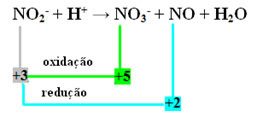
- Lai līdzsvarotu šo reakciju ar redoksu, mums NOX ir jāattiecina uz produktiem, nevis ar reaģentiem:
PIE3- = ∆Nox = 5 - 3 = 2
NO = ∆Nox = 3 - 2 = 1
- Apgriežot ∆NOX pēc koeficientiem, mums ir:
PIE3- = ONOKS = 2 → 2 būs NO koeficients
NĒ = ONOKS = 1→ 1 būs NO koeficients3-
PIE2- + H+ → 1 PIE3- + 2 NO + H2O
- Ar to mēs jau zinām, ka produktā ir 3 N, tāpēc koeficients NO2- būs 3:
3 NĒ2- + H+ → 1 NĒ3- + 2 NO + H2O
- Lai noteiktu H koeficientus+ un no H2O, atceries, ka saņemto elektronu skaits ir vienāds ar ziedoto elektronu daudzumu; tādējādi reaģenta lādiņš būs vienāds ar produkta lādiņu. Tādā veidā mēs varam izveidot šādu shēmu:
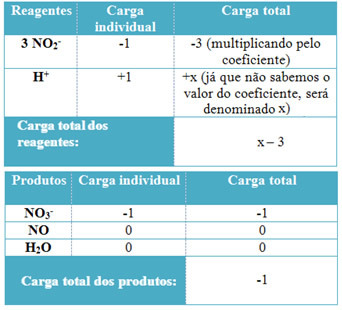
Pamatojoties uz šo informāciju, mums ir tāds, ka kopējais reaģentu lādiņš ir vienāds ar x - 3 un produkts ir vienāds ar -1. Kā minēts, abu nodevām jābūt vienādām. Tā kā mums jau ir kopējā produktu slodze, mēs varam veikt vienkāršu aprēķinu, lai uzzinātu, kāda būs x vērtība:
x -3 = -1
x = -1 +3
x = 2
Tādējādi H koeficients+ ir 2 un līdz ar to H2Būs 1:
3 NĒ2- + 2 H+ → 1 NĒ3- + 2 NO + 1 H2O
2. piemērs:
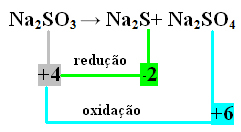
Šajā gadījumā tas bija S, kas vienlaikus piedzīvoja reducēšanu un oksidēšanu. Tādējādi, kā jau iepriekš izdarīts, mēs varam saistīt NOX ar produktiem un apgriezt to vērtības, piešķirot tiem koeficientus:
Plkst2 S = ∆Nox = 4 - (-2) = 6 → 6 būs Na koeficients2 TIKAI4
Plkst2 TIKAI4= ∆Nox = 6 - 4 = 2 → 2 būs Na koeficients2 s
Plkst2 TIKAI3→ 2 Plkst2 Y + 6 Plkst2 TIKAI4
Tā kā 2. ekstremitātē ir 8 sēru, Na koeficients2 TIKAI3 būs 8:
8 collas2 TIKAI3→ 2 collas2 S + 6 collas2 TIKAI4
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/reacoes-auto-oxirreducao.htm
