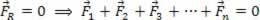Neitralizācijas reakcijas notiek, ja mēs sajaucam skābi un bāzi tā, ka barotnes pH tiek neitralizēts un rodas ūdens un sāls.
Skābe vidē izdala H katjonus+ kas saistās ar OH anjoniem- atbrīvo bāze, un līdz ar to veidojas ūdens molekulas. Sāls veidojas, savienojot skābes anjonu ar bāzes katjonu.
Parasti mums ir:
HA + Bak → H2O + BA
SKĀBĀS BĀZES ŪDENS SĀLS
Lai saprastu, kā barotne tiek neitralizēta, domājiet, piemēram, par vārglāzi, kas satur slāpekļskābi, kuras pH ir aptuveni 2,0. Pieņemsim, ka skābei pamazām pievienojam magnēzija pienu. Magnēzija piens ir magnija hidroksīda bāzes šķīdums, kura pH ir aptuveni 10,0.
Jo augstāks ir šķīduma pH, jo tas būs bāziskāks, un otrādi.
Laika gaitā slāpekļskābes pH palielināsies, kas nozīmē, ka magnezija piens to neitralizē. Pienāks brīdis, kad barotnes pH sasniegs vērtību, kas vienāda ar 7,0, kas ir ūdens pH. Tad mēs sakām, ka vide ir neitrāla.

Tā ir pilnīga neitralizācija, ko var izteikt ar šādu ķīmisko vienādojumu:
2 stundasPIE3 + mg(OH)2 → 2 stundas2O + Mg (NĒ3)2
SKĀBĀS BĀZES ŪDENS SĀLS NEitrāls
Pilna neitralizācijas reakcija notiek, kad H jonu daudzums+ skābes izdalītā viela ir vienāda ar OH jonu daudzumu- atbrīvo bāze.Iepriekš minētā piemēra gadījumā tika atbrīvoti divi H+ un divi oh-.
Tomēr reakcijas daļēja neitralizācija, tas ir, kurā H jonu daudzumu+ un ak- izdalās attiecīgi skābe un bāze, ir atšķirīgas.
Daļēja neitralizācija var notikt divos veidos:
1. Veidojoties sāļai ar skābu raksturu:
Šeit ir piemērs: Kaut arī katra fosforskābes formula atbrīvo trīs H+, katra nātrija hidroksīda bāzes molekula izdala tikai vienu OH-. Tādējādi ne visus skābē esošos jonizējamos ūdeņražus neitralizē bāzē esošie hidroksili. Rezultāts ir a veidošanās skābs sāls, ko sauc arī par ūdeņraža sāls:
H3Putekļi4 + Inak → H2O + InH2Putekļi4
SKĀBES BĀZES ŪDENS SĀLSKĀBE
2. Veidojot sāli ar pamata raksturu:
Šeit notiek pretējais iepriekšējam gadījumam, jo bāze izdala vairāk hidroksilu nekā skābe - jonizējamos ūdeņražus. Tādā veidā saražotais sāls būs a bāzes sāls vai hidroksisāls.
Piemērs: Sālsskābe izdala tikai vienu H katjonu+, savukārt magnija hidroksīds izdala divus OH-. Tādā veidā hidroksils paliks neitralizēts:
HCl + Mg(OH)2 → H2O + mg(OH)Cl
PAMĀKĀS SKĀBES ŪDENS BĀZE
Tieši šāda reakcija notiek mūsu kuņģī, kad mums ir grēmas un lietojam antacīdu. Kuņģa sulas galvenā sastāvdaļa ir sālsskābe (HCl), daži faktori, piemēram, pārtika, nervu spriedze un slimības var palielināt HCl daudzumu mūsu kuņģī, radot šo sajūtu dedzināšana. Lai neitralizētu šo skābo vidi, kuņģa antacīdi, piemēram, magnēzija piens (Mg (OH)2), var lietot medicīniskā palīdzībā. Tādā veidā tiks neitralizēts liekais kuņģa skābums.

Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/reacoes-neutralizacao.htm