Mēs to varam atzīmēt ikreiz, kad palielinām viena vai visu reaģentu koncentrāciju, kas piedalās ķīmiskajā reakcijā, palielinās tā attīstības ātrums, tas ir, reakcijas ātrums.
Ir arī pretējs. Piemēram, pašlaik tiek ieteikts parastā alkohola vietā lietot spirta želeju, jo ir mazāks risks, ka tā izdegs un tādējādi izvairīsies no negadījumiem. Parastais šķidrais spirts faktiski ir spirta un ūdens maisījums, ar želejas spirtu satur mazāku spirta daudzumu. Tāpēc, samazinot viena no degšanas reaģentu koncentrāciju, spirta gadījumā reakcija norit lēnāk. No otras puses, jo tīrāks spirts, jo ātrāk notiek sadegšanas reakcija.

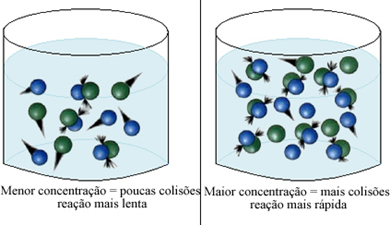
Kā teikts tekstā Nosacījumi ķīmisko reakciju rašanās gadījumam, viens no nosacījumiem, lai notiktu reakcija, ir efektīva sadursme starp daļiņām. Tādējādi reaģentu koncentrācijas palielināšanās ļauj iegūt lielāku daļiņu vai molekulu daudzumu vienā telpā. Tas palielina sadursmju daudzumu starp tām un palielina arī varbūtību, ka notiks efektīvas sadursmes, kuru rezultātā notiks reakcija. Rezultāts ir tāds, ka reakcija notiek ātrāk.
Lai to redzētu, padomājiet par šādu piemēru: kad mums ir dedzinoša smarža un mēs vēlamies, lai šī sadegšana noritētu ātrāk, vai mēs izpūšam vai ventilējam šo cilvēku? Kāpēc tas darbojas?
Nu, viens no reaģentiem šajā degšanas reakcijā ir skābeklis gaisā. Kad mēs kratām, gaisa strāva noņem pelnus, kas veidojas sadegšanas laikā, un tas atvieglo skābekļa saskari ar sparu. Tādā veidā mēs palielinām kontaktu starp reaģentiem un paātrinām sadegšanas reakciju.
Īsumā mums ir:

Strādājot ar gāzēm, viens no veidiem, kā palielināt reaģentu koncentrāciju, ir pazeminiet spiedienu. To darot, mēs samazinām tilpumu un līdz ar to palielinās reaģentu koncentrācija.

Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm
