Lorenso Romano Amedeo Karlo Avogadro (1776-1856) bija itāļu ķīmiķis, kurš vispirms iedibināja ideju, ka elementa paraugam, kura masa gramos ir skaitliski vienāda ar tā atomu masu, vienmēr ir vienāds atomu skaits (N).
Pats Avogadro nespēja noteikt N vērtību. Tomēr visā divdesmitajā gadsimtā tehnoloģiju un zinātnisko zināšanu attīstība ļāva citiem zinātniekiem izstrādāt paņēmienus, kā to noteikt. Kad šī vērtība beidzot tika atklāta, tā tika izsaukta Avogadro konstante, par godu šim zinātniekam, jo tieši viņš lika pamatus tā radīšanai.

Lorenso Romano Amedeo Karlo Avogadro (1776-1856)
1 molā jebkuras vienības (atomi, molekulas, elektroni, formulas vai joni) ir precīzi Avogadro konstantes vērtība.
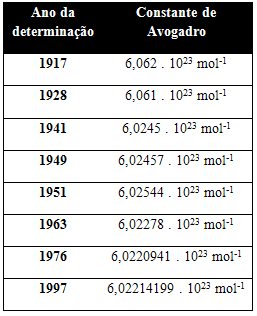
Zemāk esošajā tabulā ir norādītas dažas 20. gadsimtā iegūtās Avogadro konstantes vērtības:
Šeit ir daži no paņēmieniem, ko izmanto, lai mēģinātu noteikt Avogadro konstantes vērtību:
Pirmais zinātnieks, kas veica aptuvenu aprēķinu Avogadro konstantei, bija Johans Džozefs Lošmids. 1867. gadā viņš balstījās uz gāzu kinētisko teoriju un noteica, cik molekulu ir 1 cm3 no gāzes.
Vēl viens no šiem zinātniekiem bija francūzis Žans Baptiste Perrins (1870–1942), kurš suspensijā saskaitīja koloidālo daļiņu skaitu tilpuma vienībā un izmēra to masas. Viņa atrastā vērtība bija no 6,5 līdz 7,2. 1023 vienības uz mol. Šis zinātnieks 1913. gadā publicēja grāmatu Les Atomes (1. izdev. Paris: Alcan), un tā 9. izdevumā, kas tika publicēts 1924. gadā, bija 16 veidi, kā eksperimentāli iegūt Avogadro konstanti.

Žans Baptiste Perrins (1870–1942)
Gadus vēlāk zinātnieks Džeimss Dewars (1842–1923) izmantoja metodi, ko gadiem iepriekš izstrādāja radiohīmiķis Bertrams Boltvuds (1870–1927) un fiziķis Ernests Rutherford (1871-1937), kas galvenokārt sastāvēja no radioaktīvā avota izstaroto alfa daļiņu skaitīšanas un iegūtās hēlija gāzes tilpuma noteikšanas. Dewar atrastā vērtība bija 6,04. 1023 mol-1.
Vēl 20. gadsimtā Roberts Millikans (1868-1953) veica eksperimentu, lai noteiktu elektrona lādiņu (1.6. 10-19 Ç). Tā kā 1 mola elektronu lādiņš jau bija zināms (96500 C), bija iespējams saistīt šīs divas vērtības un atrast šādu vērtību Avogadro konstantei: 6.03. 1023 mol-1.
Pašlaik ieteiktā Avogadro konstantes vērtība ir 6,02214 x 1023 mol-1 un to nosaka ar rentgena difrakciju, kurā tiek iegūts dažu kristāliskā režģa atomu tilpums, ja vien ir zināms 1 mola atomu blīvums un masa paraugā.
Didaktikas nolūkos vidusskolā, kur aprēķiniem nav jābūt tik precīziem kā aprēķini, kas veikti ķīmiskās laboratorijās, Avogadro konstante tiek uzskatīta par 6,02. 1023 mol-1.
Ir arī vienkāršākas metodes, kuras var izmantot, lai palīdzētu studentiem praksē noteikt Avogadro konstanti. Viens no tiem notiek elektrolīzes ceļā ūdens vidē.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm