Pēc notekūdeņu attīrīšanas pirmajiem diviem posmiem tagad parunāsim par pēdējo soli. Ja jums nebija iespējas uzzināt par šīm iepriekšējām metodēm, piekļūstiet šiem tekstiem:
- Notekūdeņu attīrīšanas veidi;
- Sekundārās notekūdeņu apstrādes.
Terciārā notekūdeņu attīrīšana sastāv no tfizikāli ķīmiskās vai bioloģiskās metodes īpaši piesārņotāji kas nav noņemti ar citiem biežāk sastopamiem procesiem. Daži no šiem specifiskajiem piesārņotājiem var būt organiskās vielas, bioloģiski nesadalāmi savienojumi, barības vielas, smagie metāli.
Šīs terciārās apstrādes var ietvert vairākus posmus, kas būs atkarīgi no notekūdeņu piesārņojuma veida un vēlamās attīrīšanas pakāpes. Turklāt dažādos procesus, ko var izmantot terciārajā ārstēšanā, var iedalīt divos galvenajos veidos:
* Fāžu pārsūtīšanas tehnoloģijas: piesārņotājs vienkārši tiek nodots citam agregācijas stāvoklim, tas ir, tas pāriet no ūdens fāzes uz citu fāzi, kuru var nogādāt atmosfērā vai pārveidot par cietajiem atkritumiem. Pēdējais notiek, piemēram, ar aktivētās ogles adsorbcijas metodi, kas tiks paskaidrota vēlāk.
* Destruktīvas tehnoloģijas: piesārņotājs faktiski tiek pārveidots, tas ir, pārstāj pastāvēt kā tāds. To panāk ar organisko vielu oksidēšanu, kas noved pie ķīmiskām sugām, kuras arvien vairāk oksidējas, līdz notiek to pilnīga mineralizācija. Ķīmiskā oksidēšana ir apstrādes veids, kas arī tiks paskaidrots tālāk.
Tagad skatiet galvenos terciārā notekūdeņu attīrīšanas piemērus:
* Mikrofiltrācija: ir atdalīšanas process, izmantojot membrānas ar porām mikrometru skalā (1 µm = 10 μm)-6 m) kurā spēks, kas veicina piesārņojošo cieto vielu šķidras daļas atdalīšanu, ir spiediens caur membrānu un tās porām.
* Nokrišņi un koagulācija: Koagulējošās ķimikālijas, kas veido pārslas, pievienojot suspendētajai vielai, pievieno ūdenim. Piemēram, pievienojot kaļķi dzelzs saturošām notekcaurulēm, rodas pārslas, kas iegrimst konteinera apakšā.
* Adsorbcija (aktivētā ogle): Piesārņotāji adsorbējas uz ogļu virsmas: tie tiek pārnesti. Adsorbcija var notikt divos veidos: ķīmiska vai fiziska. Ķīmiskā adsorbcija vai hemisorbcija notiek caur ķīmiskām saitēm, galvenokārt ar kovalentām saitēm. No otras puses, fiziska adsorbcija vai fizisorbcija notiek, izmantojot Van der Vālsa tipa starpmolekulārās mijiedarbības, piemēram, inducēto dipola spēku un pastāvīgo dipola spēku.
* Jonu apmaiņa: izmanto noteiktus polimērus ar vietām, kas var noturēt jonus. Tādējādi ūdenī esošos piesārņojošos jonus, kas tiek turēti polimēru sveķos, var apmainīt pret citiem joniem ar tādu pašu lādiņu. Piemēram, ja šis jonu apmaiņas sveķis ir katjonisks, tajā var būt H joni+, kas tiek apmainīti pret sāls katjoniem vai pat smagajiem metāliem, kas atrodas notekūdeņos. Ja jonu apmaiņas sveķi ir anjoni, tajā var būt OH joni- kas tiek apmainīti pret notekūdeņos esošajiem anjoniem. Tātad H joni+un ak- kas atrodas ūdenī, izejot no sveķiem, reaģē, veidojot vairāk ūdens.
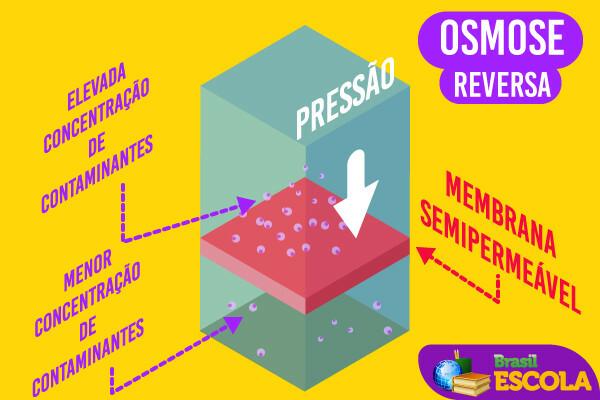
* Apgrieztā osmoze: Pieliekot spiedienu, tīrs ūdens no notekūdeņiem tiek izvadīts caur daļēji caurlaidīgu polimēru organiskā materiāla membrānu, kurai joni nevar iziet cauri. Šo metodi izmanto, piemēram, ūdens atsāļošanai. Skatiet, kā tas tiek darīts tekstā Reversā osmoze jūras ūdens atsāļošanā.

reversās osmozes ilustrācija
* Ultrafiltrācija: Tas ir selektīvs frakcionēšanas process, kurā tiek izmantots spiediens virs 145 psi (10 bar).
* Elektrodialīze: elektriskās šūnas iekšpusē vertikāli un pārmaiņus novieto daļēji caurlaidīgu membrānu sēriju. Caur šo membrānu var iziet tikai mazi katijoni vai anjoni. Tādā veidā tiek pielietota elektriskā strāva, kas izraisa ūdens sadalīšanos tā jonos. Tie savukārt migrē uz atbilstošajiem poliem, tas ir, katijoni migrē uz katodu un anjoni uz anodu. Tādējādi alternatīvās zonās šķidrums ir koncentrētāks un citās - mazāk koncentrēts jonos. Koncentrētā jonu daļa tiek izmesta, un attīrītais ūdens tiek izmests vidē.
* Hlorēšana: Hloru (gāzveida hloru vai nātrija hipohlorītu) ūdenim pievieno divām galvenajām darbībām, kas ir: iznīcināt vai atcelt patogēno mikroorganismu, aļģu un baktēriju darbību un (2) darbojas kā ūdenī esošo organisko un neorganisko savienojumu oksidētājs. Papildus dezinfekcijai var izraisīt arī "hlora" pievienošana smakas kontrole, BOD (Bioķīmiskais skābekļa pieprasījums) noņemšana, mušu izplatīšanās kontrole, cianīdu un fenolu iznīcināšana, kā arī slāpekļa noņemšana.
* Ozonēšana: Ozons (O3) tiek izmantots, jo tas darbojas kā spēcīgs oksidētājs, turklāt to viegli absorbē ūdens. To galvenokārt izmanto bioloģiski nesadalāmu organisko savienojumu oksidēšanai.

ozona molekula
* PAO (uzlaboti oksidācijas procesi): Papildus ozonam ķīmisko oksidēšanu var veikt arī, izmantojot ūdeņraža peroksīdu vai citu parasto oksidētāju. Lai paātrinātu šos procesus, tiek izmantoti ārkārtīgi oksidējoši un slikti selektīvi radikāļi, kurus var iegūt. izmantojot dažādas kombinācijas starp ultravioleto starojumu, skābekļa peroksīdu, ozonu un fotokatalizatori.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/tratamentos-terciarios-efluentes.htm