Plkst organiskās eliminācijas reakcijas ir tie, kuros molekulas atomi vai atomu grupas tiek noņemti vai izvadīti no tās, izveidojot jaunu organisko savienojumu papildus neorganiskajam savienojumam, ko veido tā daļa, kas bija dzēsts.
Viens no eliminācijas reakciju veidiem ir dehidratācija, kurā zaudētā molekula ir ūdens. Spirtu (savienojumu, kuru OH grupa ir piesaistīta piesātinātam ogleklim atklātā ķēdē) dehidratācija var notikt divos veidos: intramolekulāri un starpmolekulāri.
"Intra" nozīmē "iekšpusē", tāpēc spirtu intramolekulārā dehidratācija notiek, kad ūdens molekula iziet no pašas spirta molekulas “iekšpuses”. Šajā gadījumā izveidojies organiskais produkts būs alkēns.
Šī reakcija notiek tikai katalizatora klātbūtnē, kas darbojas kā žāvētājs, un lielākoties tā ir koncentrēta sērskābe (H2TIKAI4) un temperatūrai jābūt aptuveni 170 ° C.
Piemērs:
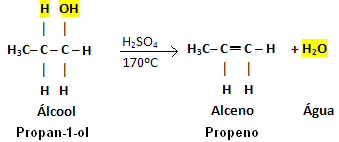
Ņemiet vērā, ka OH grupa aizgāja un ūdeņradis atstāja kaimiņu oglekli, radot ūdeni. Turklāt tika izveidota divkāršā saite, kas radīja alkēnu.
Dehidratācijas slimnīcā notiek šāda dilstošā secībā:
Terciārie spirti> Sekundārie spirti> Primārie spirti
Bet kā ir ar OH grupas nonākšanu oglekļa ķēdes vidū? Ūdeņraža atoms, no kura blakus esošais oglekļa atoms tiks atbrīvots un veido ūdens molekulu?
Piemēram, nākamais ir 2-metilpentān-3-ols. Ņemiet vērā, ka viens blakus esošais oglekļa atoms ir terciārs (izcelts ar sarkanu krāsu), bet otrs ir sekundārs (izcelts ar zilu krāsu):
H OH H
│ │ │
H3C─ Ç ─ Ç ─ Ç ─ CH3
│ │ │
H H CH3
Ūdeņradi, kas saistīts ar terciāro oglekļa atomu, būs vieglāk atstāt, jo tā elektronegatīvais raksturs ir vienāds ar δ+1Tādējādi, jo mazāk negatīvs ir oglekļa raksturs, jo vājāka ir saikne starp tiem un jo vieglāk būs viņu saiti pārtraukt.
Šādos gadījumos tiek veidoti visi iespējamie savienojumi, tomēr pārsvars tiks piešķirts secībā: Terciārie spirti> Sekundārie spirti> Primārie spirti.
Tātad mums ir:
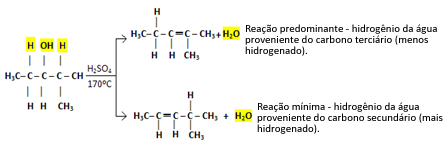
Šis reakcijas veids pakļaujas Saitzefa likums, kas to saka būs lielāka tendence ūdeņradim atstāt oglekli mazāk hidrogenētu. Šis noteikums ir tieši pretējs Markovņikova likums izmanto pievienošanas reakcijām.
Lai papildinātu zināšanas par šo tēmu, izlasiet arī tekstu "Alkohola starpmolekulārā dehidratācija”.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/desidratacao-intramolecular-dos-Alcoois.htm

