ķīmiskais elements fosfors (P) pieder periodiskās tabulas trešajam periodam un slāpekļa (VA) saimei. Šī iemesla dēļ tā atomi parasti veido trīs ķīmiskās saites lai sasniegtu okteta teorija (stabilitāte). Tomēr ir dažas situācijas, kurās fosfora atoms izveido vairāk nekā trīs saites, un tas ir iespējams tikai ar hibridizācijas parādība.
Lai saprastu fosfora hibridizācija, vispirms mums jāsaprot, kāpēc šī elementa atoms izveido trīs saites. Lai to izdarītu, mums vienkārši jāuzrauga jūsu elektroniskā izplatīšana:

Elektroniskā fosfora izplatīšana
Mēs varam novērot, ka valences slānī fosfora atomam ir pilnīgs 3s apakšlīmenis (ar divi elektroni) un nepilnīgajam 3p apakšlīmenim (katrai no trim p apakšlīmeņa orbitālēm ir a elektrons). Zemāk mums ir elektronu sadalījums apakšlīmeņu orbitālēs Fosfora valences slānis:
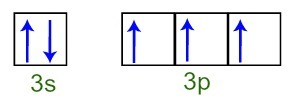
Fosfora atoma valences apvalka elektronu attēlojums
Tā kā katra no 3p apakšlīmeņa orbitālēm ir nepilnīga, fosfora atoms spēj izveidot trīs ķīmiskās saites, tādējādi panākot stabilitāti.
Tagad, kad mēs aplūkojam vielu PCl
5, piemēram, mēs esam pārliecināti, ka šajā molekulā fosfors tika pakļauts hibridizācijai, jo tas izveidoja piecus savienojumus. Tā kā hloram, kas pieder VIIA saimei, nepieciešama saite, lai tā būtu stabila, un molekulā ir pieci šī atomi katram no tiem ir jāveido saite, kas savukārt fosfora atomam ir jāpadara arī pieci Savienojumi. Šis gadījums ir iespējams tikai caur fosfora hibridizācija (nepilnīgu atomu orbitāļu savienošana).Saņemot enerģiju no ārējās vides, fosfora atoma elektroni kļūst satraukti. Drīz pēc tam viens no diviem elektroniem, kas pieder 3. apakšlīmenim, pāriet uz tukšu orbitālu, kas atrodas apakšlīmenī d, kurā līdz tam nav elektronu. Skatiet zemāk redzamo diagrammu:
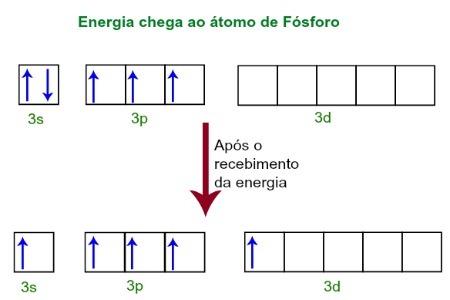
Saņemot enerģiju, fosfora elektroni ir satraukti, un viens aizņem d apakšlīmeņa orbitālu.
Šajā brīdī fosfora valences slānī mums ir s orbitāle, trīs p orbitāles un nepilnīga d orbitāle.Galu galā šīs piecas orbitāles hibridizējas, tas ir, apvienojas, kā rezultātā rodas piecas nepilnīgas atomu orbitāles, kas tagad spēj izveidot piecas ķīmiskās saites.

Nepabeigtu fosfora atomu orbitāļu hibridizācija
Tā kā s orbitālei, trim p orbitālēm un d orbitālei tika pievienotas, fosfora hibridizācija ir tāda veida sp3d.
Autors: Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm

