Savienojumu fizikālo un ķīmisko īpašību analīze, kas veic kovalentās saites (daloties elektronos), parāda, ka starp šiem materiāliem ir lielas atšķirības. Bet pirms mēs aplūkojam šīs īpašības, redzēsim, kāda ir atšķirība starp molekulārajām un kovalentajām vielām.
Plkst molekulāras vielas tie ir tie, kas veidojas, kad atomi ir saistīti ar kovalentām saitēm, radot noteikta skaita molekulas.
Tomēr kovalentā saite var arī radīt savienojumus tīkla struktūrā ar ļoti lielu un nenoteiktu atomu skaitu, kas ir makromolekulas. Šādas vielas sauc kovalenti savienojumi vai kovalenti tīkla cietie materiāli. Daži šo savienojumu piemēri ir: dimants (C), grafīts (C), silīcija dioksīds (SiO2) un silīcija karbīds (SiC).
Tagad apskatīsim tā galvenās īpašības:
- Agregātstāvoklis istabas temperatūrā: Apkārtējos apstākļos tiek atrasti molekulārie un kovalenti savienojumi trijos fiziskajos stāvokļos (cieta, šķidra un gāze).
Piemēri:
O Ciets: cukurs (saharoze), silīcija dioksīds (smiltis), dimants, grafīts;
O Šķidrums: ūdens, acetons, etanols;
O Gāzveida: Sērūdeņradis, hlora gāze, broma gāze, ūdeņraža gāze.

- Kušanas un viršanas temperatūra: Parasti šo vielu kušanas un viršanas temperatūras ir mazākas nekā jonu vielām.
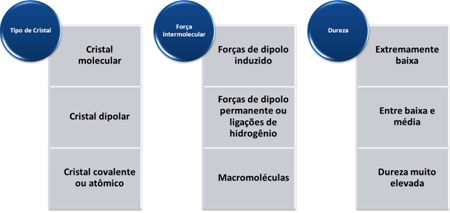
Kovalentām vielām ir augstāka viršanas temperatūra nekā molekulārajām, vienmēr virs 1000 ° C. Tas notiek tāpēc, ka tā molekulas ir ciešāk savienotas, veidojot kristāliskus režģus, tāpēc ir nepieciešams nodrošināt vairāk enerģijas, lai tās mainītu savu stāvokli.
Kovalento un molekulāro savienojumu viršanas un kušanas temperatūru traucē divi faktori: a molārā masa un starpmolekulārais spēks.
Jo lielāka molārā masa, jo lielāka ir molekulas inerce un līdz ar to augstāka viršanas un kušanas temperatūra. Ja molārās masas ir tuvinātas, mēs aplūkojam starpmolekulāros spēkus. Visintensīvākais starpmolekulārais spēks ir ūdeņraža savienojums, kas noved pie augstākas viršanas un kušanas temperatūras. Starpprodukts ir pastāvīgais dipols, un vājākais, kas noved pie zemākas viršanas un kušanas temperatūras, ir inducētais dipols.
- Elektriskā strāva: Tīrā veidā gan šķidrumi, gan cietas vielas nevada elektrisko strāvu.
Izņēmums ir grafīts, kas elektrisko strāvu vada cietā formā, jo tā dubultās saites elektroni rezonē un tāpēc tiem ir noteikta mobilitāte.
- Šķīdība: Polāri izšķīst polāros, bet nepolāri - polārajos.
- Izturība: Kovalento vielu izturība pret triecieniem vai mehāniskiem triecieniem ir maza. Parasti tās ir trauslas cietas vielas, kā parādīts stikla gadījumā, ko veido nātrija un kalcija silikāti.

- Stingrība: Kopumā viņiem ir augsta cietība. Izņemot grafītu, jo tā oglekļa atomi ir saistīti ar trim citiem oglekļa atomiem, veidojot sešstūra plāksnes ar noteiktu kustīgumu, padarot to mīkstu. Tādēļ to pat izmanto kā smērvielu.
Šo vielu cietība mainās atkarībā no kristāla veida, kā parādīts zemāk esošajā tabulā:
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/propriedades-dos-compostos-covalentes-moleculares.htm


