Jauda, kas savienojumiem jāpiesaista elektriskiem lādiņiem, tiek definēta kā polaritāte, kurai ir atšķirīgs raksturs atkarībā no savienojuma, kurā tā atrodas.
Visbiežāk organisko savienojumu saites notiek starp oglekļa atomiem vai starp oglekļa un ūdeņraža atomiem: C ─ C un C ─ H (ogļūdeņraži). Mēs klasificējam šāda veida saites kā kovalentās, tās ir visās organisko savienojumu saitēs, kuras veido tikai ogleklis un ūdeņradis.
Ja organiskā savienojuma molekulā bez oglekļa un ūdeņraža ir vēl viens ķīmiskais elements, tā molekulām būs noteikta polaritāte. Mēs šo elementu saucam par heteroatomu, un tas var būt: slāpeklis (N), skābeklis (O), cita starpā.
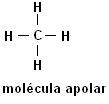
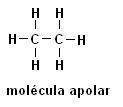
Metāns (CH4) Etāns (C.2H6)
Ņemiet vērā, ka abās struktūrās nav heteroatomu, šajā gadījumā molekulas tiek klasificētas kā nepolāras.


Skābekļa kā heteroatomu klātbūtne liek molekulām demonstrēt polaritāti. Pirmā molekula ir savienojums Etanols (CH3CH2ak), hidroksil-OH klātbūtne piešķir šim savienojumam polāru raksturu, pat ja tā struktūrā satur nepolāru daļu.
Autore Líria Alves
Beidzis ķīmiju
Brazīlijas skolu komanda
Redzēt vairāk! plakans izomērs
Organiskā ķīmija - Ķīmija - Brazīlijas skola
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/moleculas-organicas-polares-apolares.htm
