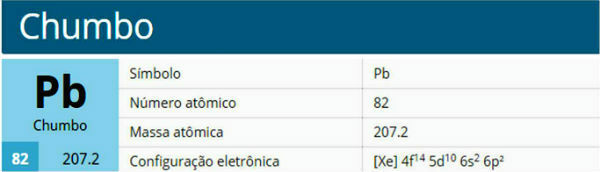
THE kopīga koncentrācija, ko sauc arī par koncentrāciju g/l, ir attiecība starp izšķīdušās vielas masu šķīduma tilpumā.
Matemātiski kopējo koncentrāciju izsaka ar formulu:
C = m/v
kur,
C: kopējā koncentrācija;
m: izšķīdušās vielas masa;
V: šķīduma tilpums.
Visbiežāk lietotā mērvienība kopējai koncentrācijai ir g/l, jo izšķīdušās vielas masu aprēķina gramos (g) un šķīduma tilpumu litros (L).
Piemēram, jūras ūdenī ir liels daudzums izšķīdušo sāļu un viens no tiem ir nātrija hlorīds (NaCl), tautā saukts par galda sāli.
Nātrija hlorīda koncentrācija jūras ūdenī ir vidēji 2,5 g/l. Tātad katrā 1 litrā jūras ūdens, kas ir šķīdums, ir 2,5 grami sāls, kas ir izšķīdināta viela.
Kā aprēķināt kopējo koncentrāciju?
Šķīdums ir viendabīgs maisījums, ko veido viela mazākā daudzumā, ko sauc par izšķīdušo vielu, kas izšķīdināta šķīdinātājā, kura daudzums ir lielāks.
Tādējādi kopējā koncentrācija attiecas uz izšķīdušās vielas daudzumu noteiktā šķīduma tilpumā. Jo vairāk izšķīdušās vielas šķīdumā izšķīdināts, jo tā ir koncentrētāka. Pretējā gadījumā, tas ir, zems izšķīdinātājs norāda, ka šķīdums ir atšķaidīts.
1. piemērs: Kāda ir sudraba jodīda (AgI) šķīduma koncentrācija g/l, kas satur 2,6 g 1 l šķīduma?
Ja ir norādīts izšķīdušās vielas daudzums un šķīduma tilpums, mēs vienkārši ievietojam vērtības kopējā koncentrācijas formulā, lai atrastu tās vērtību.
Tāpēc 2,6 g/l sudraba jodīda šķīdumā katrā 1 litrā šķīduma ir 2,6 g izšķīdušās vielas.
2. piemērs: Iztvaicējot šķīdinātāju no 500 ml fizioloģiskā šķīduma ar koncentrāciju 6 g/L, kāda ir iegūtās izšķīdušās vielas masa?
Ņemiet vērā, ka dažos aprēķinos mēs varam atrast kopējo aprakstīto koncentrāciju, lai mēs varētu aprēķināt izšķīdušās vielas masu.
Ir arī jāpievērš uzmanība vienībām. Tā kā kopējā koncentrācija ir norādīta g/l, šajā gadījumā pirms formulas piemērošanas mums ir jāpārvērš tilpuma vienība.
Tā kā 1 L satur 1000 ml, tā 500 ml atbilst 0,5 l.
Tādējādi, iztvaicējot šķīdinātāju no šķīduma ar koncentrāciju 6 g/L, tika iegūti 12 g izšķīdušās vielas.
Iegūstiet vairāk zināšanu par saturu:
- Šķīduma koncentrācija
- molārā koncentrācija
- Šķīdumu atšķaidīšana
Atrisināja kopīgus koncentrēšanās vingrinājumus
Izmantojiet šādus jautājumus, lai pārbaudītu iepriekš iegūtās zināšanas.
jautājums 1
(Unicamp) Šķīdinātāju pilnībā iztvaicē no 250 ml MgCl ūdens šķīduma2 koncentrācija 8,0 g/l. Cik gramus izšķīdušās vielas iegūst?
a) 8.0
b) 6.0
c) 4.0
d) 2.0
e) 1.0
Pareizā alternatīva: d) 2.0.
2. jautājums
Skatīt attēlu zemāk.

Šajā shēmā 3. konteinerā ir a
a) neviendabīgs maisījums
b) tīra viela
c) Risinājums
d) koloīdu maisījums
Pareizā alternatīva: c) Risinājums.
3. konteinerā ir šķīdums, kas ir viendabīgs maisījums, ko veido šķīdinātājs un šķīdinātājs, kur sāls ir šķīdinātājs un ūdens ir šķīdinātājs.
Parasti mēs varam teikt, ka izšķīdinātā viela ir komponents vismazākajā daudzumā un šķīdinātājs ir sastopams vislielākajā daudzumā.
1. konteinerā ir neviendabīgs maisījums ar 3 fāzēm, un konteiners 2 atbilst neviendabīgam 2 fāžu maisījumam.
3. jautājums
Šķīdumu sagatavoja, izšķīdinot 4,0 g magnija hlorīda MgCl2 līdz tiek sasniegta koncentrācija 2,0 g/l. Kāds šķīduma tilpums tika sagatavots?
a) 1 l
b) 2 l
c) 4 l
d) 6 l
Pareizā alternatīva: b) 2 L.
Skatiet vairāk problēmu ar komentēto risinājumu vietnē parastie koncentrēšanās vingrinājumi.
Bibliogrāfiskās atsauces
FONSEKA, M. R. M. Ķīmija, 1. 1. ed. Sanpaulu: Atika, 2013.
SANTOS, W.L.P; MOL, G.S. Pilsoņu ķīmija, 1. 2. ed. Sanpaulu: redaktors AJS, 2013.
USBERKO, Dž. Savienojiet ķīmiju, 1. 2. ed. Sanpaulu: Saraiva, 2014.
- Kopīgas koncentrēšanās vingrinājumi ar komentētām atsauksmēm
- ķīmiskie šķīdumi
- Šķīdinātājs un šķīdinātājs: kas tie ir, atšķirības un piemēri
- Šķīduma koncentrācija
- Šķīdība
- Molaritāte vai molārā koncentrācija: kas tas ir, formula un kā aprēķināt
- Šķīdumu atšķaidīšana
- Vingrinājumi par matērijas īpašībām