THE oksidēšanās un samazināšana ir reakcijas, kas rodas, ja ir a elektronu pārnese starp ķīmiskajām sugām. Tās ir pretējas reakcijas: oksidēšanā notiek elektronu zudums un reducēšanās gadījumā elektronu pieaugums.
Šie procesi notiek vienlaicīgi, jo, vielai nododot elektronus citai, tā tiek oksidēta, savukārt viela, kas saņem elektronus, tiek redukta.
Kad viela oksidējas, tā izraisa citu sugu reducēšanos, līdz ar to arī reducētāja nosaukumu. Tāpat viena viela reducējas, oksidējoties citai, un tāpēc tā ir oksidētājs.
Oksidācijas un reducēšanas reakcijas parāda iesaistīto sugu oksidācijas skaita (nox) izmaiņas.
Parasti reakciju, kurā notiek oksidēšana un reducēšana, var attēlot ar:
A + B+ → A+ + B
kur,
A: viela, kas oksidējas, zaudē elektronus, palielina savu vērtību un ir reducētājs.
B: viela, kas tiek reducēta, iegūst elektronus, samazina oksidāciju un ir oksidētājs.
Oksidācijas un reducēšanas piemēri
Redox ķīmiskā vienādojuma piemēru skatiet nākamajā attēlā.
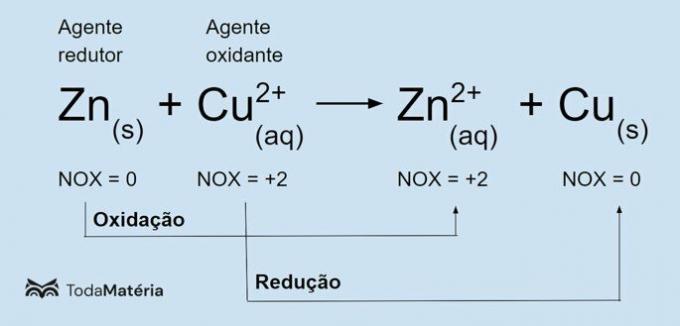
Tiek pakļauts metāliskajam cinkam oksidēšanās
un izraisa vara reducēšanu, tāpēc tas ir reducētājs. Tā oksidācijas skaitlis (nox) palielinās no 0 līdz +2, jo tas zaudē 2 elektronus.Vara jons (Cu2+) tiek reducēts un izraisa vara oksidēšanos, tāpēc tas ir oksidētājs. Tā oksidācijas skaitlis (nox) samazinās no +2 līdz 0, jo tas iegūst 2 elektronus un kļūst par metālisku varu, kas ir elektriski neitrāls.
Citi redoksreakciju piemēri ikdienas dzīvē ir:
metāna sadedzināšana
CH4(g) + 2O2(g) → CO2(g) + 2H2O(v)
Fotosintēze
6CO2(g) + 6H2O(v) → C6H12O6 (šeit) + 6O2(g)
dzelzs korozija
2Fe(s) + 3/4O2(g) + 3 stundas2O(v) → 2Fe (OH)3(s) (rūsa Fe2O3.3H2O)
Uzziniet vairāk par oksidācijas numurs (nox).
Kā notiek oksidācijas un reducēšanas reakcijas?
Redoksreakcijas vienādojumu, kurā iesaistīts varš un cinks, var attēlot ar pusreakcijām, kā parādīts zemāk.
- oksidācijas pusreakcija: Zn0(s) → 2e- + Zn2+(šeit)
- Pusreakcijas samazināšana: dupsis2+(šeit) + 2e- → dupsis0(s)
- globālais vienādojums: Zn0(s) + dupsis2+(šeit) → Zn2+(šeit) + dupsis0(s)
Šī elektronu pārnešana redoksreakcijā notiek atbilstoši iesaistīto sugu reducēšanas potenciālam. Komponentei ar viszemāko reducēšanas potenciālu ir tendence ziedot elektronus, bet tā, kurai ir vislielākais potenciāls, tos saņems.
Piemēram, cinka reducēšanas potenciāls ir -0,76 V, bet vara reducēšanas potenciāls ir +0,34 V. Tāpēc cinks, jo tam ir mazāks reducēšanas potenciāls, ir labāks reducētājs un veicina reducēšanu varš, kam ir lielāks reducēšanas potenciāls, un tāpēc tas iegūst elektronus un izraisa cinka oksidāciju.
Lasiet arī par redoksreakcijas.
Vingrinājumi oksidēšanai un reducēšanai
Izmantojiet šādus jautājumus, lai pārbaudītu savas zināšanas par to, ko esat iemācījušies šajā tekstā.
jautājums 1
Attiecībā uz oksidācijas un reducēšanas reakcijām ir pareizi teikt, ka
a) Ķīmisko sugu nox pieaugums liecina, ka tas ir samazinājies.
b) Viela, kas zaudē elektronus, tiek pakļauta oksidācijai un ir oksidētājs.
c) Redoksreakcijās tiek pārnesti elektroni.
d) Viela, kas iegūst elektronus, tiek reducēta un ir reducētājs.
e) Ķīmiskās sugas nox samazināšanās liecina, ka tā ir oksidējusies.
Pareiza alternatīva: c) Oksidācijas-reducēšanas reakcijās notiek elektronu pārnese.
Redoksreakcijās tiek pārnesti elektroni.
Viela, kas iegūst elektronus, tiek reducēta un ir oksidētājs. Ķīmisko sugu nox samazinājums liecina, ka tas ir samazināts.
Viela, kas zaudē elektronus, tiek oksidēta un ir reducētājs. Ķīmisko sugu nox palielināšanās liecina, ka tā ir oksidējusies.
2. jautājums
Redoksreakciju piemēri ikdienas dzīvē, IZŅEMOT
a) Korozija
b) degšana
c) Fotosintēze
d) neitralizācija
Nepareiza alternatīva: d) Neitralizācija.
Neitralizācijas reakcija ir reakcija, kas notiek starp skābi un bāzi, kā rezultātā rodas sāls un ūdens. Piemēram:
NaOH + HCl → NaCl + H2O
Redoksreakcijas piemēri ir:
metāna sadedzināšana
CH4(g) + 2O2(g) → CO2(g) + 2H2O(v)
Fotosintēze
6CO2(g) + 6H2O(v) → C6H12O6 (šeit) + 6O2(g)
dzelzs korozija
2Fe(s) + 3/4O2(g) + 3 stundas2O(v) → 2Fe (OH)3(s)
3. jautājums
Ievērojiet šādas oksidācijas-reducēšanas reakcijas un norādiet, kuri ir oksidētāji un reducētāji.
es Zn0(s) + dupsis2+(šeit) → Zn2+(šeit) + dupsis0(s)
II. Ass2+(šeit) + H2(g) → 2H+(šeit) + dupsis(s)
III. Zn(s) + 2H+(šeit) → Zn2+(šeit) + H2(g)
Atbildēt:
Redoksreakcijā tas, kas tiek oksidēts, ir reducētājs, un tas, kas tiek reducēts, ir oksidētājs.
es Zn0(s) + dupsis2+(šeit) → Zn2+(šeit) + dupsis0(s)
Oksidētājs: varš (Cu)
Reducētājs: cinks (Zn)
II. Ass2+(šeit) + H2(g) → 2H+(šeit) + dupsis(s)
Oksidētājs: varš (Cu)
Reducētājs: ūdeņradis (H)
III. Zn(s) + 2H+(šeit) → Zn2+(šeit) + H2(g)
Oksidētājs: ūdeņradis (H)
Reducētājs: cinks (Zn)
Iegūstiet vairāk zināšanu par saturu:
- Kas ir kaudzes?
- elektroķīmija
- Elektrolīze
Bibliogrāfiskās atsauces
FONSEKA, M. R. M Ķīmija, 2. 1. ed. Sanpaulu: Atika, 2013.
SANTOS, W.L.P; MOL, G.S. Pilsoņu ķīmija, 3. 2. ed. Sanpaulu: redaktors AJS, 2013.
USBERKO, Dž. Savienot ķīmiju, 2: ķīmija. - 2. ed. Sanpaulu: Saraiva, 2014.