Ķīmiskā kinētika pēta ķīmisko reakciju ātrumu un faktorus, kas ietekmē šo reakciju ātrumu.
Izmantojiet tālāk sniegtos jautājumus, lai pārbaudītu savas zināšanas un apskatītu komentārus par rezolūcijām.
jautājums 1
Attiecībā uz faktoriem, kas ietekmē ķīmiskās reakcijas ātrumu, NEPAREIZI ir apgalvot, ka:
a) Jo lielāka reaģentu koncentrācija, jo lielāks reakcijas ātrums.
b) Jo lielāka ir kontakta virsma, jo lielāks ir reakcijas ātrums.
c) Jo lielāks spiediens, jo ātrāk notiek reakcija.
d) Jo augstāka temperatūra, jo ātrāk notiek reakcija.
e) Katalizatora klātbūtne uztur nemainīgu reakcijas ātrumu.
Nepareiza alternatīva: e) Katalizatora klātbūtne uztur nemainīgu reakcijas ātrumu.
Katalizatori palielina reakcijas ātrumu, jo tie atvieglo aktivētā kompleksa veidošanos starp reaģentiem.
Tādējādi katalizatori rada īsāku reakcijas attīstības mehānismu, izraisot ātruma palielināšanos.
2. jautājums
Saskaņā ar _____________ starp reaģentiem, lai veidotos produkti, jāveic efektīvas sadursmes. Turklāt ir pietiekami daudz ___________, lai noārdītu reaģentu ķīmiskās saites un izveidotu ___________, kas ir starpstāvoklis pirms produktu veidošanās.
Vārdi, kas pareizi aizpilda tukšās vietas, ir attiecīgi:
a) entalpija, kinētiskā enerģija un katalizatora variācijas.
b) sadursmes teorija, aktivācijas enerģija un aktivētais komplekss.
c) reakcijas ātrums, entalpija un inhibitors.
d) daļējs spiediens, entropija un substrāts.
Pareiza alternatīva: b) sadursmes teorija, aktivācijas enerģija un aktivētais komplekss.
Saskaņā ar sadursmju teoriju reaktantu sadursmes ir nepieciešamas, lai notiktu ķīmiska reakcija. Lai to izdarītu, vielām jābūt labvēlīgā stāvoklī, lai triecieni būtu efektīvi.
Aktivizācijas enerģija darbojas kā enerģijas barjera, kas jāpārvar, lai pārrautu reaģējošo savienojumu saites. Jo zemāka aktivācijas enerģija, jo ātrāk notiek reakcija.
Aktivētais komplekss ir nestabila starpposma suga, kas izveidojusies pirms produktiem.
3. jautājums
Par katalizatoriem tiek izteikti šādi četri apgalvojumi:
Es Katalizators darbojas, palielinot reakcijas ātrumu, bet nemainot tā darbību.
II. Ķīmiskā reakcijā katalizators netiek patērēts reakcijas ceļā.
III. Katalizatori rada alternatīvu ceļu reaģentu pārvēršanai produktos. Tam nepieciešama lielāka aktivācijas enerģija.
IV. Katalizators spēj paātrināt reakciju tikai uz priekšu.
Pareizo informāciju par katalizatoriem sniedz šādas iespējas:
a) I un II
b) II un III
c) I un IV
d) Visi
Pareiza alternatīva: a) I un II.
Katalizatorus izmanto, lai paātrinātu ķīmiskās reakcijas. Reakcija, izmantojot katalizatoru, nemaina tā iznākumu, tas ir, paredzamais produkta daudzums tiek ražots, bet mazāk laika.
Katalizatori netiek patērēti ķīmiskās reakcijas laikā, tie palīdz aktivētā kompleksa veidošanā. Tāpēc ķīmiskās reakcijas beigās var atgūt katalizatoru.
Katalizatori spēj samazināt reakcijas laiku, izveidojot alternatīvu mehānismu produktu veidošanai ar zemāku aktivācijas enerģiju. Tāpēc reakcija notiek ātrāk.
Katalizatori darbojas gan reakcijas virzienā uz priekšu, gan pretējā virzienā.
4. jautājums
Cik ātri notiek ķīmiskā reakcija, ir atkarīgs no:
Es Reaģentu efektīvo sadursmju skaits.
II. Pietiekami daudz enerģijas, lai pārkārtotu atomus.
III. Labvēlīga molekulu orientācija.
IV. Aktivizēta kompleksa veidošanās.
a) I un II
b) II un IV
c) I, II un III
d) I, II, III un IV
Pareiza alternatīva: d) I, II, III un IV.
Efektīvas sadursmes notiek, kad reaģenti atrodas triecieniem labvēlīgā stāvoklī, kas veicinās atomu pārkārtošanos.
Aktivizācijas enerģijai jābūt pietiekamai, lai sadursme starp reaģentiem izraisītu saišu pārrāvumu un aktivētā kompleksa veidošanos.
Ne visi sadursmes starp reaģējošām daļiņām izraisa reakcijas norisi. Orientācija, ar kādu notiek sadursme, ir svarīga, lai notiktu produktu veidošanās.
Aktivizētais komplekss ir starpposma un nestabils stāvoklis pirms produktu veidošanās. Tas tiek radīts, kad tiek pārsniegta reakcijas aktivācijas enerģija.
5. jautājums
Oglekļa dioksīds ir gāze, kas veidojas, reaģējot starp oglekļa monoksīdu un skābekļa gāzēm, saskaņā ar zemāk norādīto ķīmisko vienādojumu.
COg) + ½2. punkta g) apakšpunkts → CO2. punkta g) apakšpunkts
Zinot, ka 5 minūšu reakcijas laikā tika patērēts 2,5 mol CO, kāds ir reakcijas attīstības ātrums atbilstoši O patēriņam2?
a) 0,2 mol. min-1
b) 1,5 mol. min-1
c) 2,0 mol. min-1
d) 0,25 mol. min-1
Pareiza alternatīva: d) 0,25 mol. min-1
Lai atbildētu uz šo jautājumu, mums jāaplūko ķīmiskais vienādojums.
COg) + ½2. punkta g) apakšpunkts → CO2. punkta g) apakšpunkts
Ņemiet vērā, ka 1 mols oglekļa monoksīda reaģē ar ½ molu skābekļa, veidojot 1 molu oglekļa dioksīda.
Paziņojumā norādītais daudzums attiecas uz oglekļa monoksīdu, bet atbildei jābūt skābekļa izteiksmē. Lai to izdarītu, mums jāizpilda trīs likums un jāatrod skābekļa daudzums.
1 mol CO - ½ mol O2
2,5 mol CO - x O2
x = 1,25 mol
Tagad mēs izmantojam vērtības reakcijas attīstības ātruma formulā.
Tāpēc reakcijas attīstības ātrums attiecībā uz skābekli ir 0,25 mol.min-1.
6. jautājums
Ievērojiet hipotētiskas ķīmiskas reakcijas attīstības grafisko attēlojumu, kas attiecas uz enerģiju un reakcijas ceļu.
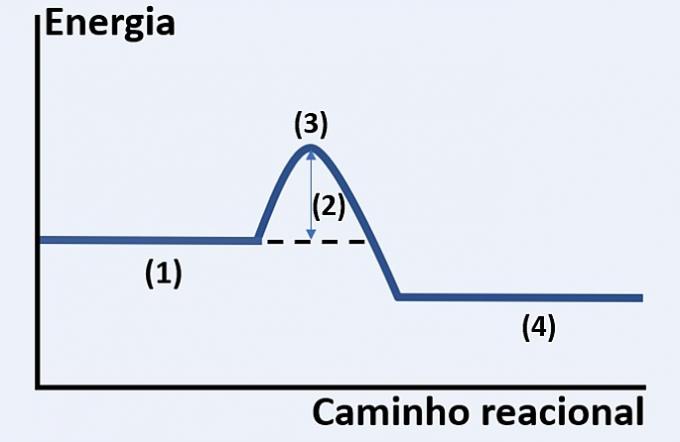
Pārbaudiet alternatīvu, kas pareizi aizstāj attiecīgi (1), (2), (3) un (4).
a) substrāti, izdalītais siltums, maksimālais enerģijas stāvoklis un reakcijas beigas.
b) reaģenti, aktivācijas enerģija, aktivētais komplekss un produkti.
c) reaģenti, kinētiskā enerģija, katalizators un substrāti.
d) reaģenti, absorbētais siltums, siltumenerģija un produkti.
Pareiza alternatīva: b) reaģenti, aktivācijas enerģija, aktivētais komplekss un produkti.
Parādītais grafiks ir endotermiska reakcija, tas ir, enerģijas absorbcija, lai notiktu reakcija.
Jūs reaģenti (1) ir diagrammas sākumā un aktivācijas enerģija (2) atbilst starpībai starp enerģiju, kas uzkrāta reaģentos un komplekss aktivizēts (3). Visbeidzot, pēc starpstāvokļa iziešanas veidojas produktiem (4).
Tāpēc reaģentiem jāpārvar aktivācijas enerģija, lai pārkārtotu savus atomus starpstruktūrā, ko sauc par aktivēto kompleksu, lai produkti veidotos.
7. jautājums
A viela spēj sadalīties un kļūt par B vielu. Novērojiet šīs reakcijas attīstību zemāk redzamajā attēlā.

Attiecībā uz reakcijas ātrumu mēs varam teikt, ka:
a) Viela A sadalās starp 0 un 15 s ar ātrumu 0,35 mol.s-1.
b) Viela A sadalās starp 15 un 30 s ar ātrumu 0,02 mol.s-1.
c) Viela A sadalās starp 0 un 15 s ar ātrumu 0,04 mol.s-1.
d) viela A sadalās starp 15 un 30 s ar ātrumu 0,03 mol.s-1.
Pareiza alternatīva: d) A viela sadalās starp 15 un 30 s ar ātrumu 0,03 mol.s-1.
A vielas sadalīšanās ātrumu var aprēķināt pēc formulas:
Aprēķināsim reakcijas ātrumu A vielas izteiksmē starp dotajiem intervāliem.
Diapazons no 0 līdz 15:
Diapazons no 15 līdz 30:
Tāpēc alternatīva d ir pareiza, jo viela A sadalās starp 15 un 30 s ar ātrumu 0,03 mol.s.-1.
8. jautājums
Apsveriet šādu hipotētisko reakciju.
aA + bB → cC + dD
Zemāk atzīmējiet A un C koncentrācijas svārstības.
| Laiks (-i) | 0 | 5 | 10 | 15 | 20 | 25 |
|---|---|---|---|---|---|---|
| A patēriņš (mol / L) | 7,5 | 6,0 | 4,5 | 3,0 | 2,5 | 1,0 |
| C veidošanās (mol / L) | 0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 |
Pamatojoties uz jautājumā sniegto informāciju, kāds ir attiecīgi A patēriņa ātrums un C veidošanās ātrums intervālā no 5 līdz 25 minūtēm?
a) 0,3 mol. L-1.s-1 un 0,1 mol. L-1.s-1
b) - 0,1 mol. L-1.s-1 un 0,3 mol. L-1.s-1
c) - 0,25 mol. L-1.s-1 un 0,1 mol. L-1.s-1
d) 0,1 mol. L-1.s-1 un 0,3 mol. L-1.s-1
Pareiza alternatīva: c) - 0,25 mol. L-1.s-1 un 0,1 mol. L-1.s-1.
Patēriņa līmenis:
C apmācības līmenis:
Tāpēc reakcijā A tiek patērēts ar ātrumu 0,25 mol.s-1, tāpēc tā vērtība ir negatīva, savukārt B veidojas ar ātrumu 0,1 mol. L-1.s-1.
Lasīt arī:
- Ķīmiskā kinētika
- termoķīmija
- Ķīmiskais līdzsvars
- Ķīmiskās reakcijas

