THE Seaborgium, simbols Sg un atomskaitlis 106, ir sintētisks ķīmiskais elements, kas atrodas periodiskās tabulas 6. grupā. Tā atklājums ir datēts ar 1974. gadu, un tas tika ieskaitīts amerikāņu grupā, kuru vadīja Alberts Ghiorso, un kuras ieguldījums bija Glens Sīborgs, kura nosaukums radīja terminu seaborgium. Tāpat kā daudzi šī reģiona elementi Periodiskā tabula, Seaborgium nosaukums tika oficiāli padarīts tikai 1997. gadā, pateicoties strīdiem un sarunām starp zinātnieku grupām.
Lai gan ir pētnieki, kas apņēmušies to pētīt, seaborgijam ir maz praktiskas izmantošanas. Tas ir saistīts ar grūtībām sintezēt šī elementa izotopus, kā arī to zemo stabilitāti. Piemēram, stabilāka seborgija izotopa pussabrukšanas periods ir aptuveni piecas minūtes.
Skatīt arī: Dubnijs — vēl viens sintētisks ķīmiskais elements periodiskās tabulas 6. grupā
Kopsavilkums par seaborgiju
- Tas ir sintētisks ķīmiskais elements, kas atrodas periodiskās tabulas 6. grupā.
- To pirmo reizi sintezēja 1974. gadā divas atšķirīgas grupas.
- Tas ir radioaktīvs elements.
- Par seaborgiju vēl nav daudz zināms, jo stabili paraugi reti tiek ražoti nozīmīgos daudzumos.
- Elements tika oficiāli atzīts par seaborgiju tikai 1997. gadā, par godu zinātniekam Glennam Sīborgam.
Nepārtrauciet tagad... Pēc sludinājuma ir vēl kas ;)
Seaborgium īpašības
- Simbols: Sg.
- Atomu skaits: 106.
- Atomu masa: 269 c.u.
- Elektroniskā konfigurācija: [Rn] 7s2 5f14 6.d4.
- Zināmākie izotopi: 269Sg (5 ± 3 minūtes pusperiods); 271Sg (3,1 ± 1,6 minūtes pusperiods).
- Ķīmiskā sērija: 6. grupa; transaktinīdi; super smagi elementi.
Seaborgium īpašības
Transaktinīdu elementiem ir raksturīgi būt radioaktīviem.. Tie ir elementi, kuru atomu skaits ir lielāks vai vienāds ar 104 (no ruterfordium, Rf). Taču dabā norisinājās neierobežoti šo elementu meklējumi un teorijas par “stabilitātes salu”.

Tas attēlotu supersmago atomu reģionu, kurā skaits protoni būtu vidēji 114, un elementi būtu lieliski Pus dzīve (laiks, kas nepieciešams, lai parauga masa samazinātos uz pusi), parādot sevi kā dzīvotspējīgu un pieejamu eksperimentāliem pētījumiem.
Tomēr kopš pagājušā gadsimta piecdesmitajiem gadiem ir veikti vairāki centieni, lai atrastu to dabiskās pēdas 80. gadu vidū Georgijs Flerovs un Gurgens Ter-Akopians teica, ka viņiem nav cerību tos atrast dabu.
Tāpat kā ar citiem transaktinīdu elementiem, ir grūti plaši izpētīt seaborgiju. Tas tāpēc, ir iespējams tikai sintezētnelielos daudzumos, kuriem irļoti īss pussabrukšanas periods, tas ir, ir maz atomi un tie turas dažas minūtes.
Tas ļāva apstiprināt, ka seaborgium faktiski būtu no 6. grupas, kā tas bija savienojuma SgO gadījumā2kl2, kas noteiktos aspektos atgādināja stabilu grupas elementu analogus savienojumus, piemēram, WO2kl2 un MoO2kl2.
Izlasi arī:Transurāniskie elementi — mākslīgie elementi, kas periodiskajā tabulā nāk aiz urāna
Seaborgium iegūšana
Tā kā seborgijs ir sintētisks elements, ir svarīgi ņemt vērā, ka dabā tas nav sastopams. Šķērslis seborgija iegūšanai papildus tam, ka ir iespējams sintezēt tikai nelielus daudzumus, ir tas, ka lai to iegūtu, ir nepieciešama augstas tehnoloģijas tehnika un ekstremāli apstākļi.
Atomi, piemēram, seborgija, veidojas reakcijas rezultātā Saplūšana vieglākus atomus, izmantojot jonu stari ļoti augstas enerģijas un ir pieejami pētīšanai tikai vidē, kas tiek uzskatīta par naidīgu lielākajai daļai ķīmisko sistēmu: izmantojot staru kūli plazma inducēts lielos daļiņu paātrinātājos.

Vēsturiski seborgijs tika sintezēts, saduroties ar joni18(skābeklis-18), kam ir 249Sal. (kalifornijs-249) kā mērķi. Tādējādi, analizējot alfa daļiņu sabrukšanu, tika apstiprināta elementa 106 sintēze.
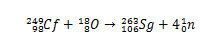
Piesardzības pasākumi, lietojot Seaborgium
Ķīmiskie elementi, piemēram, seborgijs, nerada lielus riskus, jo netiek ražots pietiekami daudz šī elementa, lai tas ilgstoši paliktu stabils. Visas rūpes, kas jāievēro, ir saistītas ar radioaktīvos paraugus, kas spēj radīt jonizējošā radiācija sabrukšanas procesos.
Uzziniet vairāk: Černobiļas avārija - lielākā kodolavārija vēsturē
Seaborgium vēsture
Tāpat kā citi īpaši smagie elementi, seborgijs tika atklāts tā sauktā pāreju kara kontekstā, gabals Aukstais karš vēsturē Ķīmija un periodiskā tabula.
Šis karš bija strīds par priekšrocību nosaukšanā ķīmiskie elementi atklāts pēc fermija (Fm, Z = 100), precīzāk starp elementiem ar atomu skaitu no 104 līdz 109, kas radās aukstā kara periodā.
Šajā strīdā laboratorijas sacentās:
- Apvienotais kodolpētniecības institūts Dubnā (agrāk bija daļa no Padomju savienība);
- Lorensa Bērklija Nacionālā laboratorija Kalifornijas Universitātē Bērklijā (Savienotās Valstis);
- Gesellschaft für Schwerionenforschung, Darmštatē (Vācija).
Jo īpaši attiecībā uz seaborgium, strīds izcēlās starp Dubnas un Bērklija laboratorijām. Tas ir tāpēc, ka 1974. gadā abas laboratorijas apgalvoja, ka ir izdevies sintezēt elementu 106.
Tomēr kopīgs ziņojums, kurā bija gan Starptautiskās tīrās un lietišķās ķīmijas savienības (IUPAC), gan Tīras un lietišķās fizikas (Iupap) pētījums, kas tika veikts 1993. gadā, secināja, ka, lai gan tas ir ļoti svarīgi turpmākai attīstībai, tu eksperimenti Dubnas laboratorijā neuzrādīja 106. elementa veidošanos pārliecinoši, tādējādi atzīstot Berkeley Laboratories jaunā elementa atklāšanu.
Iupac Neorganisko savienojumu nomenklatūras komisija (CNIC) pat ierosināja nosaukumu rutherfordium elementam 106, neņemot vērā pētnieku priekšlikumus. Pēc ilgām diskusijām Berkeley Labs komanda Alberta Giorso vadībā attiecībā uz vārdu nolēma godināt kolēģi Glenu Teodoru Sīborgu, PNobela prēmija 1951. gadā ķīmijas zinātnē, nosaucot elementu seborgiju.
Viņa dēls Ēriks Sīborgs rakstā pat stāstīja sava tēva reakciju uz šo ideju:
Ghiorso tuvojās komandas biedriem pa vienam, līdz septiņi no viņiem pamāja. Pēc tam viņš savam draugam un kolēģim 50 gadus vecam teica: “Mums ir septiņas balsis par elementa 106 nosaukšanu par seborģiju. Vai jūs pieņemtu?". Mans tēvs bija pārsteigts un, konsultējies ar māti, pieņēma.
Atrisināja vingrinājumus par seborgiju
jautājums 1
Seaborgium ir izotops ar masu 269, kura paredzamais pussabrukšanas periods ir 5 minūtes. Eksperimentā tās sintēzei zinātnieki pēc 25 minūtēm spēja atklāt 0,0025 mg seborgija izotopa 269. Sākotnējā seaborgija masa bija:
A) 0,0025 mg
B) 0,0050 mg
C) 0,0100 mg
D) 0,0200 mg
E) 0,0800 mg
Izšķirtspēja:
Alternatīva E
Pussabrukšanas periods ir laiks, kas nepieciešams, lai radioaktīvā parauga daudzums samazinātos uz pusi. 25 minūšu laikā bija 5 seaborgium pusperiods. Tādējādi ir iespējams veikt retroaktīvu analīzi:
- 0,0050 mg līdz 0,0025 mg (5. pusperiods)
- 0,0100 mg līdz 0,0050 mg (4. pusperiods)
- 0,0200 mg līdz 0,0100 mg (3. pusperiods)
- 0,0400 mg līdz 0,0200 mg (2. pusperiods)
- 0,0800 mg līdz 0,0400 mg (1. pusperiods)
2. jautājums
1974. gadā Bērklijā, Kalifornijā, Alberta Giorso vadītajai grupai izdevās sintezēt elementu 106, labi zināmā Transfēru kara laikā, kas ir daļa no aukstā kara ķīmijas vēsturē. Šim jaunajam elementam papildus atomskaitlim 106 bija masas skaitlis 263. 1997. gadā viņš tika oficiāli atzīts par seaborgiju, atsaucoties uz Giorso draugu un kolēģi Glenu Sīborgu, Nobela prēmijas ķīmijā laureāts 1951. gadā un arī dalībnieks grupā, kurai izdevās sintezēt jauno elements.
No iesniegtajiem datiem var secināt, ka neitronu skaits sintezētajā seborgijā ir vienāds ar:
A) 155
B) 157
C) 159
D) 106
E) 263
Izšķirtspēja:
B alternatīva
Skaits neitroni atomu var aprēķināt šādi:
A = Z + n
A ir skaitlis makaroni, Z ir atomskaitlis un n ir neitronu skaits.
Aizvietojot jautājuma sniegtos datus, mums ir:
263 = 106 + n
n = 157
Autors Stefano Araújo Novais
Ķīmijas skolotājs