THE izomerisms tā ir parādība, kas novērota, kad dažādus savienojumus veido vienādi vienāda veida atomi.
Tāpēc mēs varam atrast ķīmiskas vielas ar vienādu molekulāro formulu un dažādām strukturālām formulām vai telpisku izvietojumu.
Šī parādība ir plaši novērota organiskajā ķīmijā, kas pēta oglekļa savienojumus. Tā kā katrs šī elementa atoms var izveidot 4 ķīmiskās saites, ir iespējams novērot dažādas kombinācijas.
Tā kā atomu izkārtojuma maiņa rada jaunas vielas, tām ir dažādas fizikālās un ķīmiskās īpašības.
Kad mēs sakām, kuri savienojumi ir izomēri nozīmē, ka tiem ir vienādas daļas, jo vārds ir divu grieķu izcelsmes terminu kombinācija: isos, nozīmē "tiešām", un tikai, kas ir “daļas”.
Divas galvenās izomērijas grupas ir plakne un telpa (stereoizomerisms).
THE plakana izomērija to var vizualizēt ar savienojumu plakano strukturālo formulu, un tai ir piecas klases: pozīcija, funkcija, ķēde, kompensācija un tautomērija.
THE telpas izomerisms to novēro pēc savienojumu orientācijas un iedala ģeometriskajā (cis-trans) un optiskajā.
Izomērijas jēdzienu 1830. gadā ieviesa zviedru zinātnieks Jēkabs Berzēliuss.
Izomēru piemēri
THE ķēdes izomērija tas notiek, kad viena un tā pati atomu kopa savienojas, veidojot vienas funkcionālās grupas struktūras, bet ar dažādām ķēdēm.
Piemērs: molekulārā formula C4H10 ogļūdeņradis var būt taisns vai sazarots.

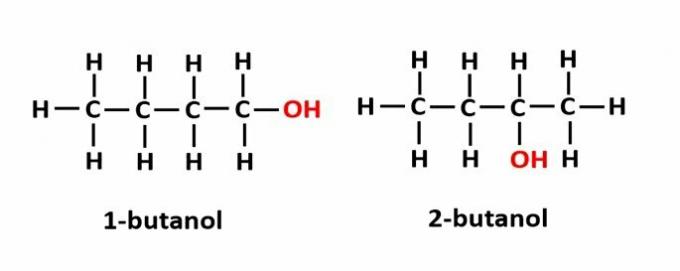
THE pozīcijas izomērija rodas, ja savienojumus veido vienas un tās pašas funkcionālās grupas, bet tās atrodas dažādās ķēdes pozīcijās.
Piemērs: molekulārā formula C4H9OH atbilst divu veidu alkoholam.
THE funkciju izomerisms rodas, ja viena un tā pati molekulārā formula atbilst diviem savienojumiem ar dažādām funkcionālajām grupām.
Piemērs: molekulārā formula C2H6O atbilst diviem izomēriem, kuriem ir spirta (-OH) un ētera (-O-) funkcijas.
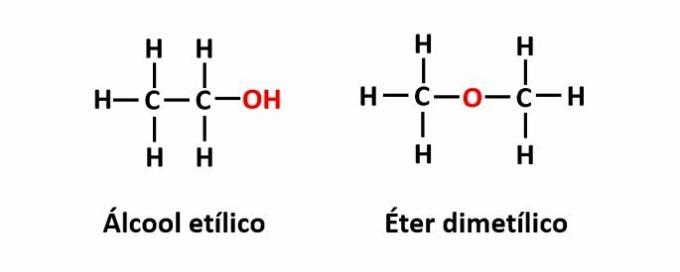
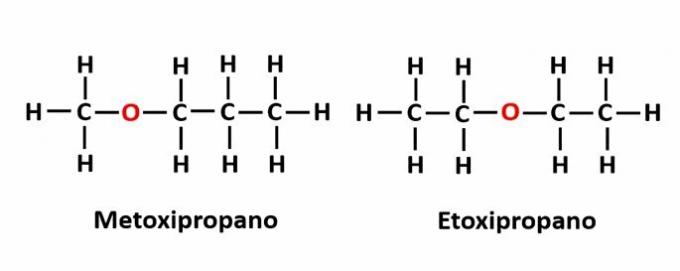
THE kompensācijas izomerisms tas rodas, ja ķēdē ir heteroatoms un tas ieņem dažādas pozīcijas. Šis ir īpašs pozīcijas izomērijas gadījums.
Piemērs: molekulārā formula C4H10Apzīmē skābekļa atoma klātbūtni ķēdē, bet tā pozīcija var mainīties un veidot dažādus savienojumus.
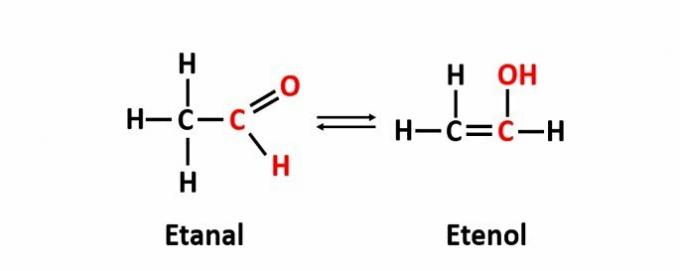
THE dinamiskā izomērija, ko sauc arī par tautomēriju, rodas, ja divi savienojumi ar dažādām funkcijām atrodas vienā šķīdumā dinamiskā līdzsvarā. Šis ir īpašs funkciju izomērijas gadījums.
Piemērs: molekulārā formula C2H4O atbilst savienojumiem ar aldehīda un enola funkcijām.
Uzziniet vairāk par plakana izomērija.
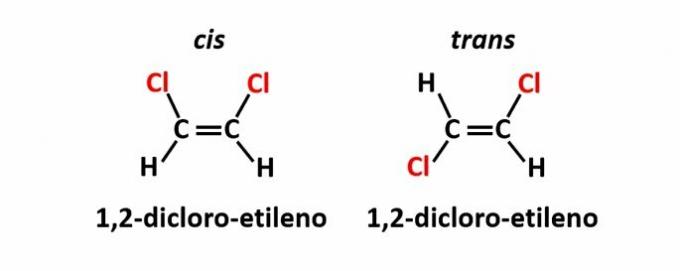
THE ģeometriskā izomērija, ko sauc arī par izomēriju cis-trans, rodas, ja dubultsaites vai cikliskās struktūras klātbūtne liek vienādiem ligandiem atrasties vienā plaknes pusē (cis) vai pretējās pusēs (trans).
Piemērs: hlora atomi savienojumos ar molekulāro formulu C2H2Cl2 tām var būt divas telpiskās struktūras.
THE optiskā izomērija rodas, ja, novirzot uz konstrukcijas izstaroto polarizēto gaismu, savienojumiem izdodas novirzīt staru gaismas pa kreisi, ja tas ir pa kreisi griežošs (l) izomērs, vai pa labi, ja tas ir pa labi rotējošs izomērs (d).
Piemērs: šāda veida izomērija rodas ar pienskābi. Tālāk ņemiet vērā, ka izomēru spektrālie attēli nepārklājas, tāpēc tos sauc par enantiomēriem.
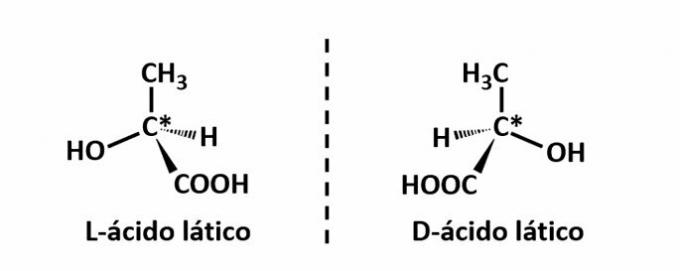
Simbols C* norāda uz hirāla oglekļa klātbūtni šajā struktūrā, ti, oglekļa atomu ar 4 dažādiem linkeriem.
Uzziniet vairāk par izomerismu ar saturu:
- Izomērijas veidi
- kosmosa izomērs
- ģeometriskais izomērs
- optiskais izomērs
- Vingrinājumi plaknes izomērijai