Redoksreakciju galvenā atšķirīgā iezīme ir tāda, ka vienlaikus viena ķīmiskā suga zaudē elektronus (oksidējot) un cita iegūst elektronus (reducējot).
Tomēr dažās reakcijās var novērot, ka notiek ne tikai oksidēšana un/vai reducēšana. Zemāk ir piemērs:
SnS + HCl + HNO3 → SnCl4 + S + NĒ + H2O
Aprēķinot visu šīs reakcijas atomu oksidācijas skaitļus (Nox), kā norādīts tekstā “Oksidācijas skaitļa (Nox) noteikšana”, mēs iegūstam:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + NĒ + H2O
Tagad pārbaudīsim, kuri no tiemVielas cieta no to Nox izmaiņām un līdz ar to oksidējās un reducējās:
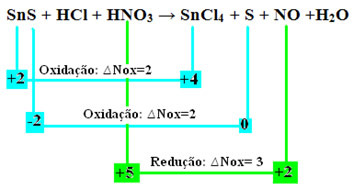
Ņemiet vērā, ka ir notikušas divas oksidācijas. Tātad, kā tādā gadījumā līdzsvarot ķīmisko vienādojumu?
Viena svarīga lieta, kas jāpatur prātā, kas attiecas uz visām redoksreakcijām, ir tā atdoto elektronu skaitam vienmēr jābūt vienādam ar saņemto elektronu skaitu.
Tāpēc, lai līdzsvarotu šāda veida reakciju, ievērojiet tos pašus noteikumus, kas noteikti tekstā "Redox balansēšana”, tomēr tikai ar vienu izmaiņu:
Nox variācijas (∆Nox) noteikšana sugām, kas radīja divas oksidācijas (SnS), būs divu ∆Nox summa, kas mums dos kopējo zaudēto elektronu vērtību:- SnS: ∆Kopējais Nox = (∆Nox SnCl4) + (∆Nox S)
SnS: ∆Kopējais NOx = 2 + 2 = 4
- HNO3: ∆Nox = 3
Tātad balansēšanai varam veikt šādas darbības:
Nepārtrauciet tagad... Pēc reklāmas ir vēl kas ;)
- SnS: ∆Kopējais NOx = 4 → 4 būs HNO koeficients3;
- HNO3: ∆Nox = 3 → 3 būs SnS koeficients.
3 SnS + HCl + 4 HNO3 → SnCl4 + S + NĒ + H2O
Līdzsvarošanas turpināšana ar izmēģinājuma metodi:
- Tā kā jums ir 3 Sn un 3 S pirmajā loceklī, tie būs arī jūsu koeficienti otrajā loceklī:
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 J+NĒ+H2O
- Līdz ar to otrajam dalībniekam palika 12 Cl (3. 4 = 12), tātad 12 būs tās vielas koeficients, kurā Cl ir atrodams pirmajā loceklī, kas ir HCl:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO + H2O
- Tagad mums ir 16 H pirmajā lodziņā (12 + 4 = 16), līdz ar to H koeficients2O būs vienāds ar 8, jo 8, reizinot ar ūdeņraža indeksu, kas ir 2, iegūst 16:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO +8H2O
- Turklāt 1. loceklī ir arī 4 N, tātad 4 būs arī N koeficients otrajā loceklī:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 NO + 8 H2O
Ņemiet vērā, ka skābekļa daudzums 1. ekstremitātē (3. 4 = 12) ir vienāds ar šī elementa kopējo daudzumu 2. daļā (4 + 8 = 12). Tātad reakcija ir līdzsvarota.
Autore: Dženifera Fogača
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu kādā skolā vai akadēmiskajā darbā? Skaties:
FOGAÇA, Dženifera Roča Vargasa. "Reakcijas ar vairāk nekā vienu oksidēšanu un/vai reducēšanu"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm. Skatīts 2021. gada 27. jūlijā.