reakcijas ar bāzes oksīdi ir ķīmiskas parādības, kurās šīs oksīdu klases viela tiek ievietota vienā traukā ar a neorganiskā skābe, a skābes oksīds vai vienu amfoteriskais oksīds.
Skatīt arī:Reakcijas ar amfoteriskajiem oksīdiem
neorganiskā sāls un ūdens ir izplatīti produkti a reakcija ar bāzes oksīdiem. Lai noskaidrotu, vai tiks ražots neorganiskais sāls vai ūdens, mums ir jāaplūko viela, kas reaģentā pavada pamata oksīdu. Skatiet tālāk sniegtos piemērus un izprotiet, kā šis process notiek.
Reakcijas ar bāziskiem oksīdiem un neorganiskām skābēm
Reakcijās starp bāziskajiem oksīdiem un neorganiskām skābēm veidojas neorganisks sāls un ūdens, jo bāzes oksīda katjons (Y+) mijiedarbojas ar anjonu (X-) skābes un hidronija katjonu (H+) skābes mijiedarbojas ar oksīda anjonu:
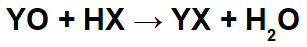
Piemērs: Rādija oksīds un bromūdeņražskābe
Šajā reakcijā kā reaģenti ir rādija oksīds (RaO) un bromūdeņražskābe (Hbr). Tādējādi notiek šāda mijiedarbība:
Radio katjons (Ra+2) ar bromīda anjonu (Br-1), veidojot rādija bromīda sāli (RaBr2).
Hidronija katjons (H+1) ar oksīda anjonu (O-2) veidojot ūdeni (H2O).
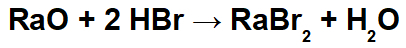
Skatīt arī:Reakcijas ar dubultoksīdiem
Reakcijas ar bāziskiem oksīdiem un skābiem oksīdiem
Šajās reakcijās neorganiskais sāls veidojas, mijiedarbojoties starp pamata oksīda katjonu (Y+) un iegūto skābes anjonu (WOThe-) ķīmiskās reakcijas starp skābes oksīdu un ūdeni.
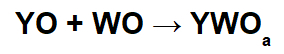
Piemērs: Nātrija oksīds un sēra dioksīds
Šajā reakcijā mums ir nātrija oksīds (Na2O) un sēra dioksīds (SO2). Jāatzīmē, ka sākotnēji, skābes oksīdam mijiedarbojoties ar ūdeni, veidojas sērskābe (H2TIKAI3):
Nepārtrauciet tagad... Pēc reklāmas ir vēl kas ;)

No šīs skābes veidošanās mijiedarbība starp nātrija katjonu (Na+1) bāzes oksīda un sulfīta anjona (SO3-2), veidojot nātrija sulfīta sāli (Na2TIKAI3):
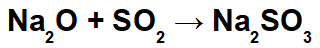
Reakcijas ar bāziskiem oksīdiem un amfoteriskajiem oksīdiem
Amfoteriskie oksīdi ir vielas, kurām ir divējāda ķīmiskā izturēšanās: skābas vielas klātbūtnē tas darbojas kā bāzisks oksīds; bāziskas vielas klātbūtnē tas uzvedas kā skābes oksīds.
Tātad, kad a bāziskais oksīds reaģē ar amfoterisku oksīdu, tas izturēsies kā skābes oksīds, ūdens klātbūtnē veidojot neorganisku skābi. Reakcija starp neorganiskās skābes anjonu un bāzes oksīda katjonu veidos sāls produktu.
Piemērs: Kālija oksīds un hroma III oksīds
Šajā reakcijā kā reaģenti ir kālija oksīds (K2O) un hroma oksīds (Cr2O3). Jāatzīmē, ka sākotnēji, kad amfoteriskais oksīds mijiedarbojas ar ūdeni, veidojas hromosomu skābe (2HCrO2):

No šīs skābes veidošanās notiek mijiedarbība starp kālija katjonu (K+1) bāzes oksīda un hromīta anjona (SO3-2) skābes, veidojot kālija hromīta sāli (2KCrO2):

Es. Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu kādā skolā vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Reakcijas ar bāzes oksīdiem"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/reacoes-com-oxidos-basicos.htm. Skatīts 2021. gada 27. jūlijā.
Sāls nomenklatūra, sāls klasifikācija, anjonu nosaukums, katjonu nosaukums, dzelzs sulfāts, dzelzs sulfāts, nitrāts sudraba, kālija hlorīda, nātrija hlorīda, kalcija hlorīda, sudraba nitrāta, vara sulfāta, karbonāta kalcijs.