Jo augstāka temperatūra, jo lielāks ir reakcijas ātrums.
To var viegli redzēt daudzās situācijās mūsu ikdienas dzīvē, piemēram, šādos piemēros:
- Kad mēs vēlamies palēnināt pārtikas sadalīšanās reakciju, mēs pazeminām temperatūru, ievietojot to ledusskapī;

- Ja mēs vēlamies paātrināt ēdiena gatavošanas reakciju, vienkārši ielieciet to vārīšanas katlā. spiediens, kas, palielinoties spiedienam, paaugstina arī šķidrā ūdens viršanas temperatūru pārtika ir;

- Ugunsgrēki parasti ir postoši, jo paaugstinās vides temperatūra, kas izraisa sadegšanas reakcijas ātruma palielināšanos;
- Palēnināt vielmaiņas ķīmiskos procesus, samazinot smadzeņu bojājumu iespējamību skābekļa deficīts, dažas operācijas tiek veiktas, pazeminot pacienta ķermeņa temperatūru, sasniedzot apkārt 15 ° C;
- Ja mēs ievietojam putojošo tableti glāzē karsta ūdens, bet otru - glāzē auksta ūdens, pirmā izšķīdīs daudz ātrāk.
Bet kas izskaidro temperatūras tieši proporcionālo ietekmi uz reakcijas ātrumu?
Tas ir tāpēc, ka, kā paskaidrots tekstā “Nosacījumi ķīmisko reakciju rašanās gadījumam
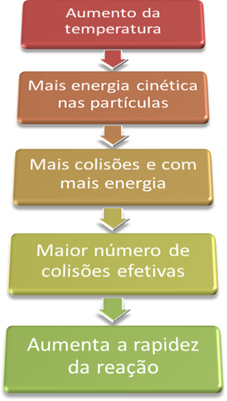
”, Lai reakcija noritētu, ir jāievēro daži nosacījumi, piemēram, ka daļiņas tiem jāsaduras efektīvi un ar minimālo nepieciešamo enerģiju, ko sauc par aktivācijas enerģiju.Tādējādi, paaugstinot sistēmas temperatūru, mēs palielinām arī reaģējošo daļiņu satraukumu un nodrošinām tām lielāku kinētisko enerģiju. Līdz ar to notiks vairāk sadursmju un ar lielāku enerģiju, palielinot reaģējošo daļiņu daudzumu un attiecīgi palielinot reakcijas ātrumu.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/temperatura-velocidade-das-reacoes.htm


