Kā teikts tekstā "Ķīmiskais vienādojums”, lai attēlotu ķīmiskās reakcijas un izprastu to apstrādes veidu, to kvantitatīvos un kvalitatīvos aspektus, tika nolemts izmantot ķīmiskos vienādojumus. Ķīmiskie vienādojumi satur simbolus un skaitļus, kas parāda, kuras vielas ir klāt, un atbilstošās proporcijas, kādās tās reaģē.
Interpretējot šos vienādojumus, ir iespējams atrast svarīgus datus, kas palīdz mums veikt stehiometriskos aprēķinus. Tomēr pirmajā solī teikts, ka vienādojumam jābūt līdzsvarotam, tas ir, reaģentu kopējam atomu skaitam jābūt vienādam ar produktu atomu skaitu. Jūs varat saprast, kā veikt šo balansēšanu, izmantojot tekstu "Vienādojuma balansēšana”.
Tomēr pirms tam šajā gadījumā izprotiet dažus svarīgus jēdzienus, piemēram, terminu nozīmi: indekss, stehiometriskais koeficients un mol. Šie termini tiks izskaidroti tālāk un sniegs mums labāku ieskatu reakcijas kvantitatīvā daļā:
- Indekss: ir skaitlis, kas norāda katra ķīmiskajās formulās esošā elementa atomu skaitu. Šis skaitlis atrodas pa labi no attiecīgā elementa un parādās apakšindeksā, tas ir, mazākā fonta izmērā.
Piemērs:
H2O (ūdens vielas ķīmiskā formula)
Ko tas nozīmē:
- Elementi, kas veido šo vielu, ir H (ūdeņradis) un O (skābeklis).
- Katra elementa indekss norāda, cik atomu katram elementam ir ūdens molekulas formulā:
H2O → O indekss: ir tikai 1 skābekļa atoms.
↓
H indekss: norāda, ka ir 2 ūdeņraža atomi.
Ņemiet vērā, ka skābekļa gadījumā nav rakstīta skaitļa, kas nozīmē, ka ir tikai 1 šī elementa atoms, kā paskaidrots iepriekš.
Tagad ir daži gadījumi, kad formulās tiek parādītas iekavas. Kā mums tas būtu jāinterpretē? Skatiet tālāk redzamo piemēru:
Šeit3(PUTEKĻI4)2(kalcija fosfāta vielas ķīmiskā formula)
- Ca saturs norāda, ka ķīmiskajā formulā ir 3 elementa kalcija atomi;
- P (fosfors) un O (skābeklis) ir iekavās, tāpēc ārpusē esošais indekss, kas šajā gadījumā ir 2, pieder abiem. Tātad, lai uzzinātu, cik daudz atomu ir katrā formulā, jums ir jāreizina to indeksi atsevišķi ar ārējo indeksu. Ņemiet vērā, kā tas tiek darīts:

Nepārtrauciet tagad... Pēc reklāmas ir vēl kas ;)
P → indekss 1 O → indekss 4
P = 1. 2 O = 4. 2
P = 2 O = 8
Tātad ir 2 fosfora un 8 skābekļa atomi.
- Stehiometriskais koeficients: ir skaitlis, kas ir pirms formulas, lai norādītu katras vielas daudzumu un reakcijā iesaistīto molekulu proporciju. Tādējādi, tāpat kā indeksa gadījumā, kad koeficients ir vienāds ar 1, tas nav jāpieraksta, kā tas tiek domāts.
Piemērs:
2H2 + 1O2 → 2 H2O (šī ūdens veidošanās reakcija ir parādīta ievada attēlā)
↓ ↓ ↓
Reakcijas koeficienti
Šajā vienādojumā, izmantojot koeficientus, ir parādīts, ka divas ūdeņraža gāzes molekulas reaģē ar vienu skābekļa gāzi, veidojot divas ūdens molekulas kā produktu. Tādējādi šīs reakcijas stehiometriskā attiecība ir 2:1:2.
Lai uzzinātu katra reakcijā esošā elementa kopējo atomu skaitu, koeficienti jāreizina ar katra elementa indeksiem:
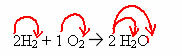
Reaģenti:
H = 2. 2 = 4 ūdeņraža atomi
O = 1. 2 = 2 skābekļa atomi
Produkts:
H = 2. 2 = 4 ūdeņraža atomi
O = 1. 2 = 2 skābekļa atomi
Ņemiet vērā, ka reaģentiem un produktiem ievadījāt vienādu daudzumu, kas nozīmē, ka reakcija ir pareizi līdzsvarota.
- Mols (vielas daudzums):ķīmiskajā vienādojumā tiek uzskatīts, ka koeficienti norāda molu vai vielas daudzumu. Tātad iepriekšējā gadījumā mums ir 2 moli H2 reaģē ar 1 molu O2, ģenerējot kā produktus 2 molus H2O.
Autore: Dženifera Fogača
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu kādā skolā vai akadēmiskajā darbā? Skaties:
FOGAÇA, Dženifera Roča Vargasa. "Kvantitatīvie termini ķīmiskajā vienādojumā"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/termos-quantitativos-uma-equacao-quimica.htm. Skatīts 2021. gada 27. jūlijā.