Polimerizācija ir ķīmiskā procesa nosaukums, kura rezultātā mazāku molekulu, monomēru, kombinācijas rezultātā veidojas makromolekulas (lielas molekulas), ko sauc par polimēriem.
reakcija uz polimerizācija tas ir ļoti izplatīts dabā, kā mēs redzam ogļhidrātos (piemēram, cietē) un olbaltumvielās (piemēram, kazeīnā pienā). Tas notiek arī sintētiski, jo lielākā daļa polimēru, ko cilvēki izmanto savā ikdienas dzīvē, ir mākslīgi izgatavoti.
Pirmais polimērs, kas ražots no polimerizācija sintētiskā bija beļģu ķīmiķa Leo Hendrika Bēkelanda 1909. gadā bakelīts.
Kopumā, lai monomērs tiktu apvienots ar citu (neatkarīgi no tā, vai tie ir vienādi vai atšķirīgi) reakcijā ar polimerizācija, ir nepieciešama brīva valence (jāveic ķīmiskā saite) abos monomēros.
Šīs valences rodas saišu pārraušanas rezultātā, izmantojot katalizatorus (piemēram, niķeli), ārējie apstākļi, piemēram, gaisma un siltums, vai struktūras rezonanses parādība (elektronu nobīde).
Veidojot polipropilēnu (PP polimēru), ko izmanto, piemēram, mājsaimniecības piederumos un rotaļlietās, pi saite (π) katrā molekulā tiek sadalīts šādi:
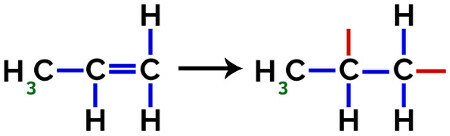
Pi saites pārrāvums propilēnā
Tādējādi katrs propilēna monomērs var savienoties ar diviem citiem propilēna monomēriem un veidot polimēru PP vai polipropilēnu (priedēklis poli norāda vairākas monomēra vienības). Visizplatītākais veids, kā attēlot polimēru, ir monomērs starp iekavām un burts n, kas norāda vairākus monomērus, kā redzams PP polimēra gadījumā:
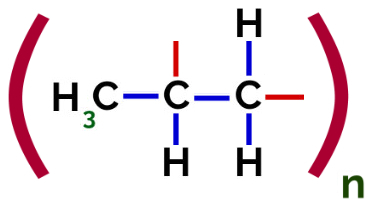
PP polimēra attēlojums
reakcija uz polimerizācija var izdarīt dažādos veidos, kā mēs redzēsim tālāk:
a) Reakcija uz pievienošanas polimerizācija
Šajā polimerizācija, monomērā vienmēr notiek pi saites pārrāvums, kā rezultātā struktūrā parādās divas brīvas valences, piemēram, veidojoties polietilēns, polimērs, ko plaši izmanto farmācijas iepakojumā.
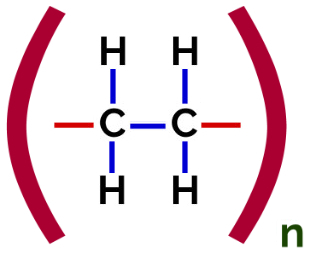
Polietilēna pievienošanas polimēra strukturālā formula
Plkst polimerizācija no polietilēna kā monomēru izmanto etilēna (etēna) molekulas, kurām ir pi saite starp diviem oglekļa atomiem. Kad šī saite tiek pārtraukta, parādās divas brīvas valences, viena uz katra oglekļa atoma, kas bija iesaistīts pi saitē. Monomēri precīzi apvienojas katrā no šīm valencēm, tas ir, viena valence ir saistīta ar otra valenci utt.
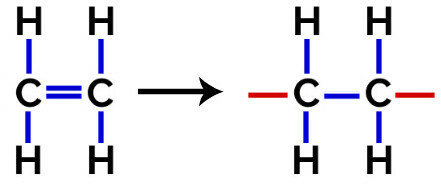
Polietilēna veidošanās vienādojums
b) Pievienošanas polimerizācijas reakcija 1.4
Šajā polimerizācijā monomēros ir divas mainīgas dubultsaites (viena pi un viena sigma), kas veicina parādību. rezonanse (mainot pi saites pi elektronu stāvokli), tāpat kā sintētiskā kaučuka (polibutadiēna) veidošanā

Polibutadiēna strukturālā formula
Šī polimēra monomēra vienība ir butadiēns, kurā ir divas mainīgas dubultās saites. Ar rezonansi struktūrai ir dubultsaite starp 2. un 3. oglekli un divas brīvas valences uz 1. un 4. oglekli. Tieši šajās brīvajās 1. un 4. oglekļa valencēs monomēri apvienojas.

Butadiēna rezonanse
c) reakcija uz kondensācijas polimerizācija vai likvidēšana
Tā ir reakcija uz polimerizācija kurā obligāti divi monomēri (vienādi vai atšķirīgi) vienlaikus zaudē atomus vai grupas, kā rezultātā katrā no tiem rodas divas brīvas valences. Tādā veidā no monomēra vienmēr tiek izvadīts ūdeņradis, kas pēc tam savienojas ar halogēnu (F, Cl, Br, I), OH, NH2, vai cita monomēra CN.
Tātad, sadaļā polimerizācija izvadot, vienmēr veidojas ūdens, halogenētā skābe (HCl, HI, HF, HBr), amonjaks (NH3) vai ciānūdeņražskābi (HCN) papildus polimēram. Skatiet, piemēram, poliestera veidošanās attēlu, kas ir materiāls, ko izmanto kā audumu:

Poliestera veidošanās vienādojums
Poliesteru veidojošie monomēri ir p-benzoldiskābe un etān-1,2-diols. Mēs to varam novērot šajā polimerizācija notiek ūdens molekulu eliminācija, jo abiem monomēriem ir divi hidroksili. Šajā procesā skābe zaudē divus hidroksilus, un dispirts zaudē tikai ūdeņradi no hidroksilgrupām:

Poliestera struktūra
Poliestera monomērus savieno spirtā esošais skābeklis un karbonskābē esošais ogleklis.
Es. Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-polimerizacao.htm