THE makaroniatomu, kā norāda nosaukums, tā ir atoma masa, ko parasti simbolizē “mThe” vai “MA”. Tomēr, tā kā atoms ir ārkārtīgi maza, cilvēka acīm neredzama vienība, tā masu nav iespējams izmērīt, piemēram, izmantojot svarus. Tātad zinātnieki noteica atomu masu, salīdzinot tos ar citu atomu masām.
Tas tiek darīts arī ar citām vienībām. Piemēram, masas mērvienība ir standarta kilograms, kas atbilst 3,917 cm augstuma un diametra cilindram, kas izgatavots no 10% irīdija un 90% platīna. Tātad tas kalpo kā salīdzinājums. Piemēram, ja mēs “nosveram” objektu uz svariem un atklājam, ka tā masa ir 10 kg, tas nozīmē, ka tā masa ir 10 reizes lielāka par izvēlēto standartu: 1 kg.
Tas pats attiecas uz atomiem. Izvēlētais standarts bija ogleklis-12, un šim atomam patvaļīgi tika piešķirta masa 12 u. “u” ir atomu masas vienība, un tāpēc tā ir vienāda ar 1/12 oglekļa atoma masas.
Piemēram, ja mēs sakām, ka ūdeņraža atomu masa ir vienāda ar 1 u, tas nozīmē, ka tas ir it kā Ja mēs sadalām oglekli 12 daļās, vienas no šīm daļām masa ir līdzvērtīga atoma masai ūdeņradis. Vēl viens piemērs ir sērs, kura atomu masa ir 32 u, kas nozīmē, ka tā masa ir 32 reizes lielāka par 1/12 no
12Ç.1 u = 1/12 no 1 oglekļa atoma masas 12

Atomu masas vienība ir 1/12 no oglekļa-12 masas
Vielu molekulmasa ir elementu atommasu summa. Piemēram, skābekļa atommasa ir vienāda ar 16 u, tātad skābekļa gāzes molekulas molekulmasa (O2) ir vienāds ar 32u.
Tā kā laboratorijas tehnika šobrīd ir ļoti attīstīta, ir ierīces, kas precīzi mēra elementu atommasu, piemēram, masas spektrometrs. Tādējādi to ir iespējams zināt 1 u ir vienāds ar 1,66054. 10-24 g.
Domu karte: atommasa

*Lai lejupielādētu domu karti PDF formātā, Noklikšķiniet šeit!
Tā kā atomu masas tiek noteiktas ar lielu precizitāti, tās ir norādītas periodiskajā tabulā decimālskaitļu veidā. Bet, veicot aprēķinus, mēs parasti izmantojam noapaļoto skaitli, izņemot eksperimentus, kuriem jābūt ļoti precīziem. Piemēram, ja paskatās uz periodisko tabulu, jūs redzēsit, ka skābekļa atomu masa ir vienāda ar 15 999 u, bet mēs aprēķinos parasti izmantojam vērtību 16 u. Tas notiek arī ar oglekli, kura atomu masa ir 12,01 u, kā parādīts zemāk:
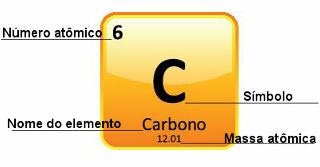
Oglekļa attēlojums periodiskajā tabulā
Periodiskajā tabulā redzamie elementi faktiski ir visu elementa dabisko izotopu vidējais svērtais lielums. Tādējādi atomu masa, kas parādās tabulā, ir arī šo elementu atomu masas vidējā vērtība. Piemēram, hloram (C?) ir divi dabiskie izotopi 35 un 37, kuru attiecīgie procenti dabā ir 75,76% un 24,24%. Katra šī izotopa atomu masa ir atšķirīga: Cβ-35 atomu masa ir 34,96885 u, bet Cβ-37 atomu masa ir 36,96590.
Tādā veidā elementa atommasa tiek aprēķināta, ņemot vērā katra izotopa masu un pārpilnību, ar kādu tas parādās dabā. Hlora gadījumā mums ir:
Elementa hlora atomu masa = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
Elementa hlora atomu masa = 35,45
Šī ir hlora atomu masas vērtība, kas parādās periodiskajā tabulā.
* Domu karte, ko veidoju es. Diogo Lopess
Autore: Dženifera Fogača
Beidzis Vēstulē
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-massa-atomica.htm


