Dažādas vielas, kas pastāv Visumā, sastāv no atomiem, joniem vai molekulām. Ķīmiskie elementi apvienojas, izmantojot ķīmiskās saites. Šīs saites var būt:
| Kovalentā saite | jonu saite | Metāla savienojums |
|---|---|---|
elektronu koplietošana |
elektronu pārnešana |
Starp metāla atomiem |
Izmantojiet zemāk minētos jautājumus, lai pārbaudītu savas zināšanas par ķīmisko savienošanu.
Piedāvātie vingrinājumi
jautājums 1
Lai interpretētu dažādu vielu īpašības, jāzina saites starp atomiem un saites starp attiecīgajām molekulām. Attiecībā uz saikni starp atomiem var teikt, ka…
(A) starp saistītiem atomiem dominē pievilkšanās spēki.
(B) kad starp atomiem izveidojas saite, izveidotā sistēma sasniedz maksimālo enerģiju.
(C) molekulas pievilcībai un atgrūšanai nav tikai elektrostatiska rakstura.
(D) starp saistītajiem atomiem ir līdzsvars starp elektrostatiskajām pievilcībām un atgrūšanām.
Pareiza alternatīva: (D) Starp saistītajiem atomiem ir līdzsvars starp elektrostatiskajām pievilcībām un atgrūšanām.
Atomus veido elektriskie lādiņi, un tieši elektriskie spēki starp daļiņām noved pie saišu veidošanās. Tāpēc visām ķīmiskajām saitēm ir elektrostatisks raksturs.
Atomiem ir spēki:
- atgrūšana starp kodoliem (pozitīvi lādiņi);
- atgrūšana starp elektroniem (negatīvie lādiņi);
- piesaiste starp kodoliem un elektroniem (pozitīvie un negatīvie lādiņi).
Visās ķīmiskajās sistēmās atomi cenšas kļūt stabilāki, un šī stabilitāte tiek panākta ķīmiskā saitē.
Stabilitāte ir saistīta ar līdzsvaru starp pievilcības un atgrūšanas spēkiem, jo atomi sasniedz zemākas enerģijas stāvokli.
2. jautājums
Pareizi saskaņojiet teikumus I slejā un saites tipu II slejā.
| Es | II |
|---|---|
| (A) Starp Na atomiem | 1. viena kovalenta saite |
| (B) Starp Cl atomiem | 2. dubultkovalentā saite |
| (C) Starp O atomiem | 3. Metāla savienojums |
| (D) Starp N atomiem | 4. jonu saite |
| (E) Starp Na un Cl atomiem | 5. trīskāršā kovalentā saite |
Atbildēt:
Atomi |
Savienojuma veidi |
Pārstāvība |
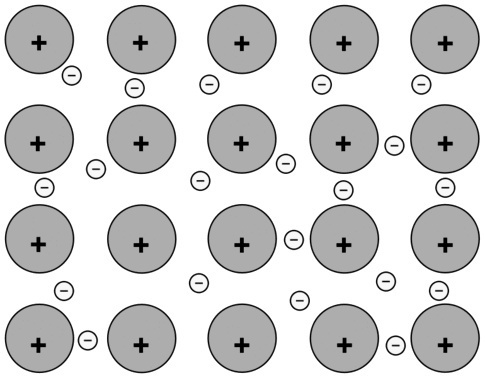
(A) Starp Na atomiem |
Metālisks savienojums. Šī metāla atomi ir savienoti kopā, izmantojot metāla saites, un mijiedarbība starp pozitīvo un negatīvo lādiņu palielina kopas stabilitāti. |
 |
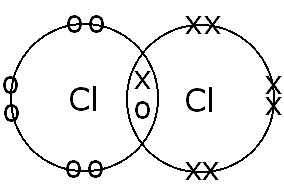
(B) Starp Cl atomiem |
Viena kovalenta saite. Elektronu koplietošana un vienas saites veidošanās notiek tāpēc, ka ir tikai viens savienojošo elektronu pāris. |
 |
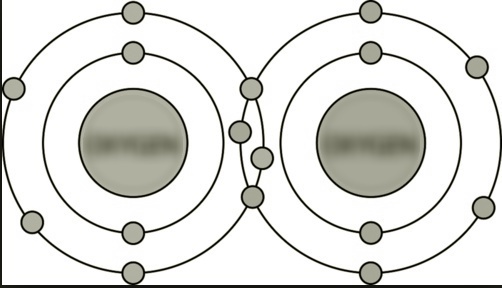
(C) Starp O atomiem |
Divkāršā kovalentā saite. Ir divi savienojošo elektronu pāri. |
 |
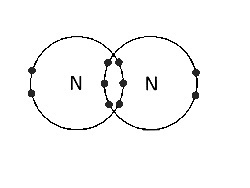
(D) Starp N atomiem |
Trīskārša kovalentā saite. Ir trīs savienojošo elektronu pāri. |
 |
(E) Starp Na un Cl atomiem |
Jonu saite. Izveidojas starp pozitīvajiem joniem (katjoniem) un negatīvajiem joniem (anjoniem), izmantojot elektronu pārnesi. |
 |
3. jautājums
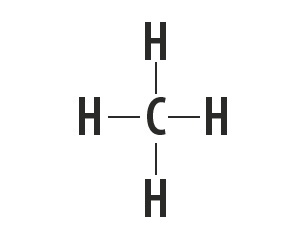
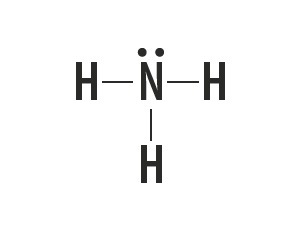
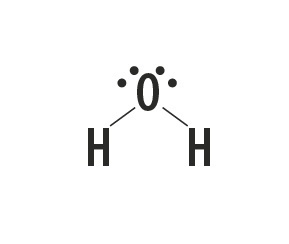
Metāns, amonjaks, ūdens un fluorūdeņradis ir molekulāras vielas, kuru Luisa struktūras ir attēlotas šajā tabulā.
| Metāns, CH4 | Amonjaks, NH3 | Ūdens, H2O | fluorūdeņradis, HF |
|---|---|---|---|
 |
 |
 |
 |
Norāda saites veidu, kas izveidojies starp atomiem, kas veido šīs molekulas.
Pareiza atbilde: vienkārša kovalentā saite.
Aplūkojot periodisko tabulu, mēs redzam, ka vielu elementi nav metāli.
Saites veids, kuru starp šiem elementiem veido, ir kovalentā saite, jo tie dala elektronus.
Oglekļa, slāpekļa, skābekļa un fluora atomi veido astoņus elektronus valences apvalkā, pateicoties to radīto saišu skaitam. Pēc tam viņi ievēro okteta likumu.
Savukārt ūdeņradis piedalās molekulāro vielu veidošanā, daloties elektronu pārī, izveidojot vienkāršas kovalentās saites.
Skatiet arī: Ķīmiskās saites
iestājeksāmena jautājumi
Jautājumi par ķīmiskajām saitēm daudz parādās iestājeksāmenos koledžās. Kā tēmai var tuvoties, skatiet tālāk.
jautājums 1
(UEMG) Noteikta materiāla īpašības var izskaidrot ar ķīmisko saišu veidu, kas atrodas starp tā veidojošajām vienībām. Laboratorijas analīzē ķīmiķis noteiktam materiālam noteica šādas īpašības:
- Augsta kušanas un viršanas temperatūra
- Laba elektrovadītspēja ūdens šķīdumā
- Slikts cietvielu elektrības vadītājs
No šī materiāla parādītajām īpašībām atzīmējiet alternatīvu, kas norāda tajā dominējošo savienojuma veidu:
(A) metālisks
(B) kovalents
(C) inducēts dipols
(D) jonu
Pareiza alternatīva: (D) jonu.
Cietam materiālam ir augsta kušanas un viršanas temperatūra, tas ir, tam būtu nepieciešams daudz enerģijas, lai mainītos šķidrā vai gāzveida stāvoklī.
Cietā stāvoklī materiāls ir vājš elektrības vadītājs atomu organizācijas dēļ, kas veido precīzi definētu ģeometriju.
Saskaroties ar ūdeni, parādās joni, veidojot katjonus un anjonus, atvieglojot elektriskās strāvas pāreju.
Saites veids, kas materiālam rada šīs īpašības, ir jonu saite.
2. jautājums
(PUC-SP) Analizējiet fizikālās īpašības šajā tabulā:
| Paraugs | Kodolsintēzes punkts | Vārīšanās punkts | Elektrovadītspēja 25 ° C temperatūrā | Elektrovadītspēja pie 1000 ° C |
|---|---|---|---|---|
| 801 ° C | 1413 ° C | izolējošs | diriģents | |
| B | 43 ° C | 182 ° C | izolējošs | |
| Ç | 1535 ° C | 2760 ° C | diriģents | diriģents |
| D | 1248 ° C | 2250 ° C | izolējošs | izolējošs |
Saskaņā ar ķīmisko saišu modeļiem A, B, C un D var attiecīgi klasificēt kā
(A) jonu savienojums, metāls, molekulāra viela, metāls.
(B) metāls, jonu savienojums, jonu savienojums, molekulāra viela.
(C) jonu savienojums, molekulāra viela, metāls, metāls.
(D) molekulāra viela, jonu savienojums, jonu savienojums, metāls.
(E) jonu savienojums, molekulāra viela, metāls, jonu savienojums.
Pareiza alternatīva: (E) jonu savienojums, molekulāra viela, metāls, jonu savienojums.
Analizējot paraugu fizikālos stāvokļus, kad tie tiek pakļauti norādītajai temperatūrai, mums:
| Paraugs | Fiziskais stāvoklis 25 ° C temperatūrā | Fiziskais stāvoklis pie 1000 ° C | Savienojumu klasifikācija |
| ciets | šķidrums | Joniskais | |
| B | ciets | Molekulāra | |
| Ç | ciets | ciets | Metāls |
| D | ciets | ciets | Joniskais |
Abi savienojumi A un D ir izolatori cietā stāvoklī (pie 25 ° C), bet, kad A paraugs mainās šķidrā stāvoklī, tas kļūst vadošs. Tās ir jonu savienojumu īpašības.
Cietvielu jonu savienojumi nepieļauj vadītspēju, jo atomi paši sakārtojas.
Šķīdumā jonu savienojumi pārvēršas jonos un ļauj vadīt elektrību.
Metāliem ir raksturīgi, ka tiem ir laba vadītspēja, piemēram, C paraugam.
Molekulārie savienojumi ir elektriski neitrāli, tas ir, izolatori, piemēram, B paraugs.
Skatiet arī: Metāla saites
3. jautājums
(Fuvest) Apsveriet elementus, kas veido hloru, attiecīgi ar ūdeņradi, oglekli, nātriju un kalciju. Ar kuru no šiem elementiem hlors veido kovalentus savienojumus?
Atbildēt:
| Elementi | Kā notiek zvans | izveidojusies saite | |
| hlors | Ūdeņradis | 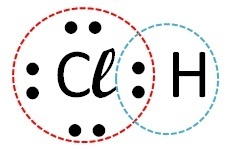 |
Kovalents (elektronu koplietošana) |
| hlors | Ogleklis | 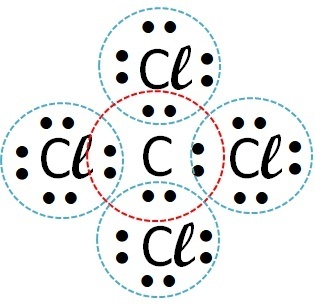 |
Kovalents (elektronu koplietošana) |
| hlors | Nātrijs |  |
Jons (elektronu pārnese) |
| hlors | Kalcijs | 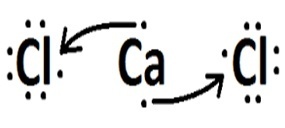 |
Jons (elektronu pārnese) |
Kovalenti savienojumi rodas nemetālu atomu, nemetālu mijiedarbībā ar ūdeņradi vai starp diviem ūdeņraža atomiem.
Tātad kovalentā saite notiek ar hloru + ūdeņradi un hloru + oglekli.
Nātrijs un kalcijs ir metāli un savienojas ar hloru caur jonu saiti.
Enem jautājumi
Enem pieeja šai tēmai var nedaudz atšķirties no līdz šim redzētā. Skatiet, kā ķīmiskās saites parādījās 2018. gada testā, un uzziniet nedaudz vairāk par šo saturu.
jautājums 1
(Enem / 2018) Pētījumi rāda, ka nanodaļas, kuru pamatā ir atomu dimensiju kustības, ko ierosina gaisma, var būt pielietojums nākotnes tehnoloģijās, aizstājot mikromotorus, bez komponentiem mehānika. Gaismas izraisītas molekulārās kustības piemēru var redzēt, saliekot plānu silīcija plāksni, savienots ar azobenzola polimēru un nesošo materiālu divos viļņu garumos, kā parādīts skaitlis. Izmantojot gaismu, rodas atgriezeniskas polimēru ķēdes reakcijas, kas veicina novēroto kustību.
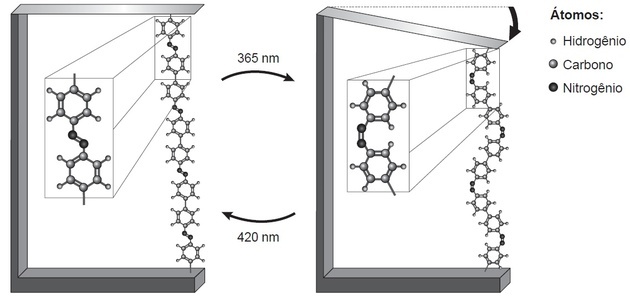
Ņemt, H. UN. Molekulu nanotehnoloģija. Jaunā ķīmija skolā, n. 21. maijs, 2005. gada maijs (pielāgots).
Molekulārās kustības parādība, ko veicina gaismas sastopamība, rodas no (a)
(A) atomu vibrācijas kustība, kas noved pie saišu saīsināšanas un atslābināšanās.
(B) N = N saišu izomerizācija, polimēra cis forma ir kompaktāka nekā trans.
(C) polimēra monomēru vienību tautomerizācija, kas noved pie kompaktāka savienojuma.
(D) rezonanse starp azogrupas π elektroniem un aromātiskā gredzena elektroniem, kas saīsina dubultās saites.
(E) N = N saišu konformācijas variācijas, kuru rezultātā veidojas struktūras ar dažādu virsmas laukumu.
Pareiza alternatīva: (B) N = N saišu izomerizācija, polimēra cis forma ir kompaktāka nekā trans.
Kustība polimēru ķēdē izraisa garāka polimēra novērošanu kreisajā pusē un īsāku labajā pusē.
Ar izcelto polimēra daļu mēs novērojam divas lietas:
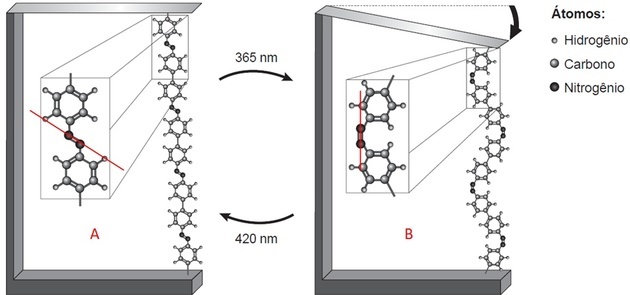
- Ir divas struktūras, kuras saista saite starp diviem atomiem (kas pēc leģendas norāda, ka tas ir slāpeklis);
- Šī saite katrā attēlā atrodas dažādās pozīcijās.
Zīmējot līniju uz attēla, A mēs novērojam, ka struktūras atrodas virs un zem ass, tas ir, pretējām pusēm. B, tie atrodas tajā pašā pusē, kur novilkta līnija.
Slāpeklis padara trīs saites stabilas. Ja tas ir saistīts ar struktūru ar saiti, tad tas ir saistīts ar citu slāpekli caur kovalentu dubulto saiti.
Polimēru sablīvēšanās un lāpstiņu locīšana notiek tāpēc, ka saistvielas atrodas dažādās pozīcijās, kad rodas N = N saišu izomērija.
Trans izomerisms tiek novērots A (savienotāji pretējās pusēs) un cis B (savienotāji vienā plaknē).
2. jautājums
(Enem / 2018) Daži cietie materiāli sastāv no atomiem, kas mijiedarbojas viens ar otru, veidojot saites, kas var būt kovalentas, jonu vai metāla. Attēlā parādīta saistīšanās potenciālā enerģija kā starpatomu attāluma funkcija kristāliskā cietā vielā. Analizējot šo skaitli, tiek novērots, ka nulles kelvina temperatūrā saites līdzsvara attālums starp atomiem (R0) atbilst potenciālās enerģijas minimālajai vērtībai. Virs šīs temperatūras atomiem piegādātā siltuma enerģija palielina to kinētisko enerģiju un izraisa tie svārstās ap vidējo līdzsvara stāvokli (piepildīti apļi), kas katram ir atšķirīgi temperatūra. Savienojuma attālums var mainīties visā horizontālo līniju garumā, kas identificēts ar T temperatūras vērtību1 T4 (temperatūras paaugstināšanās).

Novirze, kas novērota vidējā attālumā, atklāj
(A) jonizācija.
(B) dilatācija.
(C) disociācija.
(D) kovalento saišu pārrāvums.
(E) metāla saišu veidošanās.
Pareiza alternatīva: (B) dilatācija.
Atomiem ir pozitīvi un negatīvi lādiņi. Saites veidojas, sasniedzot minimālo enerģiju, līdzsvarojot spēkus (atgrūšanu un pievilcību) starp atomiem.
No tā mēs saprotam, ka: lai izveidotos ķīmiska saite, starp atomiem ir ideāls attālums, lai tie būtu stabili.
Attēlotajā attēlā redzams, ka:
- Attālums starp diviem atomiem (starpatomiem) samazinās līdz minimālās enerģijas sasniegšanai.
- Enerģija var palielināties, kad atomi kļūst tik tuvu, ka pozitīvie lādiņi to kodolos tuvojas, sāk viens otru atgrūst un attiecīgi palielināt enerģiju.
- T temperatūrā0 nulle Kelvins ir potenciālās enerģijas minimālā vērtība.
- Ir T temperatūras paaugstināšanās1 uz T4 un piegādātā enerģija liek atomiem svārstīties ap līdzsvara stāvokli (piepildīti apļi).
- Svārstības notiek starp līkni un pilnu apli, kas atbilst katrai temperatūrai.
Temperatūrai mērot molekulu maisīšanas pakāpi, jo augstāka temperatūra, jo vairāk atoms svārstās un palielinās tā aizņemtā telpa.
Augstākā temperatūra (T.4) norāda, ka būs vairāk vietas, ko aizņem šī atomu grupa, un tādējādi materiāls paplašinās.
3. jautājums
(Enem / 2019) Tāpēc, ka tiem ir pilnīgs valences slānis, augsta jonizācijas enerģija un elektroniskā afinitāte praktiski nulle, ilgu laiku tika uzskatīts, ka cēlās gāzes neveido savienojumus ķimikālijas. Tomēr 1962. gadā reakcija starp ksenonu (5s²5p⁶ valences slānis) un platīna heksafluorīdu tika veiksmīgi veikta, un kopš tā laika ir sintezēti vairāk jaunu cēlgāzes savienojumu.
Šādi savienojumi parāda, ka nevar nekritiski pieņemt okteta likumu, kurā tiek uzskatīts, ka ķīmiskajā saitē atomiem ir tendence iegūt stabilitāti, pieņemot gāzes elektronisko konfigurāciju cēls. Starp zināmajiem savienojumiem viens no stabilākajiem ir ksenona difluorīds, kurā ir divi halogēna atomi fluors (2s²2p⁵ valences slānis) kovalenti saistās ar cēlgāzes atomu, lai tajā būtu astoņi valence.
Rakstot Lewis formulu iepriekšminētajam ksenona savienojumam, cik daudz elektronu valences apvalkā ir cēlgāzes atomā?
(A) 6
(B) 8
(C) 10
(D) 12
Pareiza alternatīva: c) 10.
Fluors ir elements, kas ietilpst Periodiskās tabulas 17. grupā. Tāpēc tā visattālākajā elektroniskajā apvalkā ir 7 elektroni (2s2 2p5). Lai iegūtu stabilitāti, saskaņā ar okteta likumu šī elementa atomam ir vajadzīgs viens elektrons, lai tādējādi valences apvalkā būtu 8 elektroni un viņš pieņemtu cēlgāzes elektronisko konfigurāciju.
Savukārt ksenons ir cēlgāze, un tāpēc pēdējā slānī tam jau ir 8 elektroni (5 sekundes)2 5.lpp6).
Ņemiet vērā, ka savienojuma nosaukums ir ksenona difluorīds, tas ir, savienojumu veido divi fluora atomi un viens ksenona atoms XeF2.
Kā teikts paziņojumā, ķīmiskā saite starp atomiem ir kovalentā tipa, tas ir, notiek elektronu koplietošana.
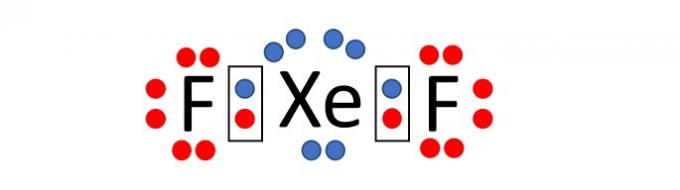
Izplatot elektronus ap katru atomu (7 ap fluoru un 8 ap ksenonu), mēs redzam ka ksenona atoms, savienojoties ar diviem fluora atomiem, fluora apvalkā ir 10 elektroni. valence.
Skatiet arī:
- okteta likums
- Elektroniskās izplatīšanas vingrinājumi
- Vingrinājumi ar ogļūdeņražiem
