Lai jūs saprastu jonizācija vispirms ir jāzina, kas ir joni. Ievērojiet tālāk sniegto skaidrojumu:
Katram atomam ir vienāds protonu un elektronu skaits; tāpēc katrs atoms ir elektriski neitrāls. Turklāt vielām, ko veido atomu grupas, ir arī elektriskā lādiņa līdzsvars, kas ir elektriski neitrāls.
Tomēr, atoms vai atomu grupa var zaudēt vai iegūt elektronus; kad tas notiek, viņi zaudē neitralitāti un kļūst par joniem.
Ja atoms vai atomu grupa zaudē elektronus, tas būs pozitīvi uzlādēts un būs jons, ko sauc katijons. Tomēr, ja jūs iegūstat elektronus, lādiņš būs negatīvs un jons būs a anjons.
Neorganiskās vielas ir joniskas vai tām piemīt spēja veidot jonus.
Viens no jonu veidošanās veidiem ir molekulāro vielu ievietošana ūdenī, tas ir, veidojas ar kovalentām saitēm, kurās dalās elektroni.
Piemēram, ja pārbaudām sālsskābes (HCl) elektrisko vadītspēju ūdens šķīdumā (hlorūdeņradis) izšķīdināts ūdenī), mēs redzēsim, ka šķīdums ir elektrolītisks, tas ir, tas vada elektrisko strāvu, jo šajā risinājums.

Tas nozīmē, ka ūdens darbojās kā reaģents, veidojot jonus no sālsskābes. Tas notiek saskaņā ar zemāk norādīto reakciju:
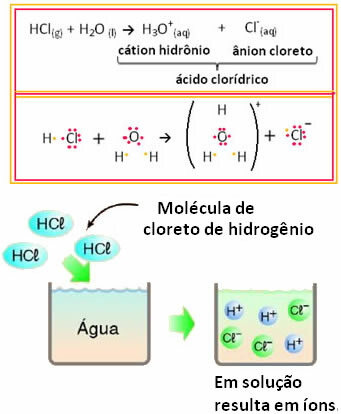
Ņemiet vērā, ka pirms ūdeņraža hlorīda ievietošanas ūdenī nebija jonu. Tomēr tā molekulas reaģēja ar ūdeni un veidoja pozitīvus H jonus3O+ (katijoni) un negatīvi Cl- (anjoni). Tā kā hlors ir vairāk elektronegatīvs nekā ūdeņradis, tas piesaista elektronu pāri no tuvu esošās kovalentās saites un veido anjonu. Savukārt ūdeņradi ūdenī piesaista skābeklis, kas ir vairāk elektronegatīvs nekā hlors; un starp ūdeņradi un skābekli izveidojas kovalentā saite, kas izraisa hidronija katjonu. Šo jonu veidošanās fenomenu saucjonizācija.
Pamatojoties uz iepriekš minēto skaidrojumu, mēs varam definēt jonizāciju šādi:

Ņemiet vērā, ka jonu iepriekš nebija, jo, ja tie pastāvētu, tāpat kā jonu savienojumu šķīdināšanas gadījumā, mums būtu jonu disociācija, nevis jonizācija.
Visas skābes, kas nonāk saskarē ar ūdeni, tiek jonizētas. Tomēr ne katrs molekulārais savienojums tiek pakļauts jonizācijai.Piemēram, cukurs (C.12H22O11) ir molekulāra, tomēr, ievietojot ūdenī, neveidojas joni, tas tikai izšķīst, radot neelektrolītu molekulāru šķīdumu, kas nevada elektrību.
Autore Jennifer Fogaça
Beidzis ķīmiju