Tīru vielu veido viena veida ķīmiskās sugas, tas ir, tās sastāvs un īpašības ir fiksētas. Maisījums satur vairāk nekā viena veida komponentus, tāpēc tā organizācija ir atšķirīga.
Tādējādi tīru vielu no maisījuma mēs varam atšķirt tikai tad, kad zinām tās sastāvu.
Salīdzinot glāzi ūdens un glāzi izšķīdināta cukura, mūsu acis nepamana atšķirību. Tomēr, ja mēs uzņemam divu glāžu saturu, mēs pamanīsim, ka viena ir tīra viela, bet otra ir maisījums.
tīras vielas
Tīra viela ir tikai vienas ķīmiskās sugas kopums, tas ir, tā nav sajaukta ar citām.
Izmantosim ūdeni kā piemēru. Ūdens (H2O) ir atzīts par tā īpašībām, un šī materiāla īpašās īpašības palīdz mums to identificēt. Galvenais ūdens īpašības viņi ir:
| Blīvums | 1,00 g / cm3 |
|---|---|
| Kodolsintēzes punkts | 0 ° C |
| Vārīšanās punkts | 100 ° C |
Kad materiālam ir nemainīgas un nemainīgas īpašības visā tā sastāvā, mēs sakām, ka tas ir a tīra viela.
Ievietojot galda sāli, nātrija hlorīdu (NaCl) glāzē ūdens un samaisot, notiks izmaiņas.

Rezultāts ir produkts ar vidēju blīvumu starp ūdeni un sāli. Tas ir tāpēc, ka ūdens vairs nav tīra viela un ir kļuvis par Sajauc.
Mēģinot sasaldēt šo maisījumu, pamanīsit, ka kušanas temperatūra būs mazāka par 0 ° C arī šis maisījums nevārīsies 100 ° C temperatūrā, lai to iztvaikotu, būs nepieciešams vairāk siltuma produktu.
Tīras vienkāršas un saliktas vielas
Tīras vielas tiek klasificētas kā vienkāršas, ja to sastāvā ir tikai viena ķīmiskā elementa atomi.
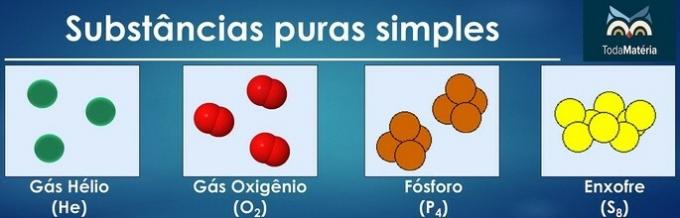
Divu vai vairāku ķīmisko elementu atomu izvietojums veido tīras saliktas vielas.

Maisījumi
Maisījums atbilst divu vai vairāku tīru vielu, kuras sauc par sastāvdaļām, savienošanai.
Atšķirībā no tīrām vielām tā īpašības nav fiksētas, jo tās ir atkarīgas no sastāvdaļu proporcijas maisījumā.
Skatiet, kā blīvums, fiziskā īpašība, mainās ar sāls daudzumu, kas sajaukts ar ūdeni.
| Sāls procentuālais daudzums procentos kopējā maisījuma masa |
Maisījuma blīvums (g / cm3) 20 ° C temperatūrā |
|---|---|
| 1 | 1,005 |
| 8 | 1,056 |
| 12 | 1,086 |
| 16 | 1,116 |
| 26 | 1,197 |
Avots: FURNISS, B. S. un citi. Vogela praktiskās organiskās ķīmijas mācību grāmata. 4. ed. Londona: Longmans, 1987. P. 1.312.
Tāpēc ūdens un sāls pievienošanai jebkurā proporcijā ir mainīgs blīvums, un tāpēc mēs nevaram klasificēt maisījumu kā ūdeni vai sāli.
Homogēni un neviendabīgi maisījumi
Homogēni maisījumi ir tie, kas komponentus uzrāda tikai vienā fāzē un līdz ar to tās pašas īpašības visos punktos.

Kad mēs vizuāli uztveram vairāk nekā vienu fāzi, maisījums tiek klasificēts kā neviendabīgs.

Kopsavilkums par tīrām vielām un maisījumiem
| Tīras vielas un maisījumi | |
|---|---|
|
viendabīga sistēma (tikai viena fāze) |
tīra viela (viena sastāvdaļa) |
|
viendabīgs maisījums (vairāk nekā viens komponents tajā pašā fāzē) | |
|
neviendabīga sistēma (vairāk nekā viena fāze) |
tīra viela (sastāvdaļa dažādos fiziskos stāvokļos) |
|
neviendabīgs maisījums (vairāk nekā viena sastāvdaļa vairāk nekā vienā fāzē) |
Lai uzzinātu vairāk, noteikti pārbaudiet šos tekstus:
- Atomi
- Ķīmiskie elementi
- Maisījumu atdalīšana
Vingrinājumi ar komentētām atsauksmēm
1. (UFMG) Tīras vielas X paraugam bija noteiktas dažas tā īpašības. Visām alternatīvām ir īpašības, kas ir noderīgas šīs vielas identificēšanai, izņemot:
a) blīvums.
b) parauga masa.
c) šķīdība ūdenī.
d) viršanas temperatūra.
e) kušanas temperatūra.
Nepareiza alternatīva: b) parauga masa.
a) PAREIZI. Blīvums ir vielas daudzums noteiktā tilpumā. Kā materiālam raksturīga īpašība tā ir noderīga vielas identificēšanai.
b) nepareizi. Masa ir vielas daudzums ķermenī. Tā kā šī īpašība attiecas uz jebkuru lietu neatkarīgi no tās uzbūves, to nav iespējams izmantot vielas identificēšanai.
c) PAREIZI. Šķīdība ir vielas spēja izšķīst vai nešķīst noteiktā šķidrumā. Kā materiālam raksturīga īpašība tā ir noderīga vielas identificēšanai.
d) PAREIZI. Vārīšanās temperatūra atbilst pārejas temperatūrai no šķidruma uz gāzveida stāvokli. Kā materiālam raksturīga īpašība tā ir noderīga vielas identificēšanai.
e) PAREIZI. Kušanas temperatūra atbilst pārejas temperatūrai no šķidruma uz cietu. Kā materiālam raksturīga īpašība tā ir noderīga vielas identificēšanai.
2. (Vunesp) Zemāk ir attēlota minerālūdens pudeles etiķete.
| Iespējamais ķīmiskais sastāvs: |
|---|
| Kalcija sulfāts 0,0038 mg / l |
| Kalcija bikarbonāts 0,0167 mg / l |
Pamatojoties uz šo informāciju, mēs varam klasificēt minerālūdeni kā:
a) tīra viela.
b) vienkārša viela.
c) neviendabīgs maisījums.
d) viendabīgs maisījums.
e) koloidālā suspensija.
Pareiza alternatīva: d) viendabīgs maisījums.
a) nepareizi. Ūdens būtu tīrs, ja tā sastāvā būtu tikai H molekulas2O.
b) nepareizi. Vienkāršu vielu veido tikai viena ķīmiskā elementa atomi. Tāpat tīrs ūdens nav vienkārša viela, jo to veido ūdeņraža un skābekļa atomi (H2O) to klasificē kā saliktu.
c) nepareizi. Heterogēnam maisījumam ir vairāk nekā viena fāze, tādā gadījumā mēs varam novērot tikai ūdeni.
d) PAREIZI. Tā kā tai ir tikai viena fāze, sistēma ir viendabīga. Aplūkojot ūdens pudeli, mēs varam redzēt tikai šķidrumu, jo kalcija sulfāts un kalcija bikarbonāta savienojumi šķīst ūdenī un tāpēc ir izšķīdināti.
e) nepareizi. Koloidālā suspensija ir neviendabīgs maisījums, kura sastāvdaļas tiek diferencētas, izmantojot mikroskopu.
3. (UCDB) Ķīmijas laboratorijā tika sagatavoti šādi maisījumi:
Es ūdens / benzīns
II. ūdens / sāls
III. ūdens / smiltis
IV. benzīns / sāls
V. benzīns / smiltis
Kurš no šiem maisījumiem ir viendabīgs?
a) Nav.
b) Tikai II.
c) II un III.
d) I un II.
e) II un IV.
Pareiza alternatīva: b) Tikai II.
a) nepareizi. Ūdens ir neorganisks savienojums, bet benzīns - organisks savienojums. Šīs vielas nespēj mijiedarboties, un tāpēc, ka tām ir atšķirīgs blīvums, tās veido neviendabīgu maisījumu.
b) PAREIZI. Sāls, nātrija hlorīds, izšķīst ūdenī, veidojot šķīdumu, kas ir viendabīgs maisījums.
c) nepareizi. Smiltis, silīcija dioksīds, veido neviendabīgu maisījumu ar ūdeni.
d) nepareizi. Sāls ir neorganisks savienojums, bet benzīns - organisks savienojums. Šīs vielas nespēj mijiedarboties, un tāpēc, ka tām ir atšķirīgs blīvums, tās veido neviendabīgu maisījumu.
e) nepareizi. Smiltis ir neorganisks savienojums, bet benzīns - organisks savienojums. Šīs vielas nespēj mijiedarboties, un tāpēc tās veido neviendabīgu maisījumu.
4. (Ufes) Labi sajauktā sistēmā, kas sastāv no smiltīm, sāls, cukura, ūdens un benzīna, fāžu skaits ir:
a) 2.
b) 3.
c) 4.
d) 5.
e) 6.
Pareiza alternatīva: b) 3.
1. FĀZE: Sāls un cukurs spēj mijiedarboties ar ūdeni, un caur starpmolekulāriem spēkiem molekulas saistās un veido šķīdumu, kas ir viendabīgs maisījums.
2. FĀZE: Ūdens ir neorganisks savienojums, bet benzīns - organisks savienojums. Šīs vielas nespēj mijiedarboties, un tāpēc, ka tām ir atšķirīgs blīvums, tās veido neviendabīgu maisījumu.
3. FĀZE: Smiltis ir silikāts, kam nav ķīmiskas afinitātes ar ūdeni un benzīnu, un tāpēc tas pārstāv fāzi.
5. (Makenzijs) Maisījums, ko veido:
a) ledus gabaliņi un cukura ūdens šķīdums (glikoze).
b) N gāzes2 un CO2.
c) ūdens un acetons.
d) ūdens un ērkšķogu sīrups.
e) petroleja un dīzeļdegviela.
Pareiza alternatīva: a) ledus gabaliņi un cukura ūdens šķīdums (glikoze).
a) PAREIZI. Ir iespējams novērot divas fāzes: ledus gabaliņus un glikozes šķīdumu, tāpēc tie ir neviendabīga sistēma.
b) nepareizi. Gāzes vienmēr ir viendabīgs maisījums.
c) nepareizi. Starp propanona karbonilu un ūdens molekulu veidojas ūdeņraža saites. Tā kā tās ir polāras vielas, acetons spēj izšķīst ūdenī un veidot viendabīgu maisījumu.
d) nepareizi. Šie divi komponenti sajaucas, veidojot viendabīgu sistēmu, jo no ērkšķogu sīrupa redzēsim tikai sarkanu šķidrumu, jo atšķaidīšana notiek, pievienojot ūdeni.
e) nepareizi. Abi ir organiski savienojumi, un ķīmiskās afinitātes dēļ tie veido vienu fāzi, kas pārstāv viendabīgu sistēmu.
Pārbaudiet savas zināšanas ar vingrinājumiem:
- Vingrinājumi ar viendabīgiem un neviendabīgiem maisījumiem
- Vingrinājumi maisījumu atdalīšanai
- Vingrinājumi par vielas īpašībām