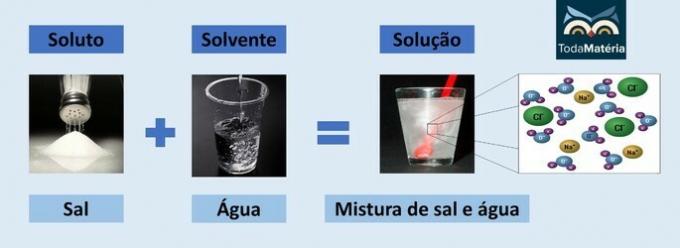
Šķīdinātā viela un šķīdinātājs ir divas viendabīga maisījuma sastāvdaļas, ko sauc par ķīmisko šķīdumu.
- Šķīdināt: ir viela, kas disperģēta šķīdinātājā. Tas atbilst vielai, kas tiks izšķīdināta, un parasti šķīdumā tā ir mazākā daudzumā.
- Šķīdinātājs: ir viela, kurā izšķīdušā viela tiks izšķīdināta, veidojot jaunu produktu. Šķīdumā tas ir lielāks daudzums.
Izšķīdināšana starp izšķīdušo (disperģēto) un šķīdinātāju (disperģējošo) notiek, mijiedarbojoties starp to molekulām.
Atšķirība starp šiem diviem šķīduma komponentiem ir tā, ka izšķīdušā viela ir viela, kas izšķīst, un šķīdinātājs ir viela, kas izraisīs izšķīšanu.
Vispazīstamākais šķīdinātājs ir ūdens, kas tiek uzskatīts par universāls šķīdinātājs. Tas ir tāpēc, ka tam piemīt spēja izšķīdināt lielu daudzumu vielu.
Šķīdinātājs un šķīdinātāja piemēri
Skatiet dažus ķīmisko šķīdumu piemērus un atrodiet katra no tiem izšķīdušās vielas un šķīdinātājus:
Ūdens un sāls
- Izšķīdis: Galda sāls - nātrija hlorīds (NaCl)
- Šķīdinātājs: ūdens
Tā kā tas ir jonu savienojums, nātrija hlorīds šķīdumā disociē un veido jonus, kurus savukārt izšķīdina Ūdens.
Ūdens pozitīvais stabs (H+) mijiedarbojas ar sāls anjonu (Cl-) un ūdens negatīvo polu (O2-) mijiedarbojas ar katjonu (Na+).
Tas ir elektrolītiskā šķīduma veids, jo šķīdumā esošās jonu sugas spēj vadīt elektrisko strāvu.
ūdens un cukurs
- Izšķīdis: cukurs - saharoze (C.12H22O11)
- Šķīdinātājs: ūdens

Cukurs ir kovalents savienojums, un, izšķīdinot ūdenī, molekulas viņi izklīst, bet nemaina savu identitāti.
Šis ūdens šķīdums tiek klasificēts kā neelektrolītisks, jo šķīdumā disperģētā izšķīdinātā viela ir neitrāla un tāpēc nereaģē ar ūdeni.
Etiķis
- Šķīdinātā viela: etiķskābe (CH3COOH)
- Šķīdinātājs: ūdens

Etiķis ir šķīdums, kas satur vismaz 4% etiķskābes, a karbonskābe kas, būdams polārs, mijiedarbojas ar ūdeni, arī polāru, izmantojot ūdeņraža saites.
Svarīgs šķīdības noteikums ir tāds, ka līdzīgs izšķīst līdzīgs. Polārie savienojumi tiek izšķīdināti polārajos šķīdinātājos, bet nepolārās vielas - ne polārajos šķīdinātājos.
Citi risinājumi
Papildus šķidriem šķīdumiem ir arī gāzveida un cietie šķīdumi.
Gaiss, ko elpojam, ir gāzveida šķīduma piemērs, kura gāzes lielākā daudzumā ir slāpeklis (78%) un skābeklis (21%).
Plkst metāla sakausējumi tie ir stabili risinājumi. Piemēram, misiņš (cinks un varš) ir maisījums, ko izmanto mūzikas instrumentu ražošanai.
Vai vēlaties iegūt vairāk zināšanu? Tāpēc izlasiet šos citus tekstus:
- Ķīmiskie risinājumi
- starpmolekulārie spēki
- Homogēni un neviendabīgi maisījumi
Kāds ir šķīdības koeficients?
Šķīdības koeficients ir šķīdinātāja robeža, kas pievienota šķīdinātājam noteiktā temperatūrā, lai izveidotu piesātinātu šķīdumu.
O šķīdības koeficients mainās atkarībā no apstākļiem un var palielināties vai samazināties atkarībā no temperatūras un attiecīgās izšķīdušās vielas izmaiņām.
Ir ierobežojums, līdz kuram šķīdinātājs var izšķīdināt.
Piemērs: Ja jūs ievietojat cukuru glāzē ūdens, pirmajā brīdī pamanīsit, ka cukurs pazūd ūdenī.
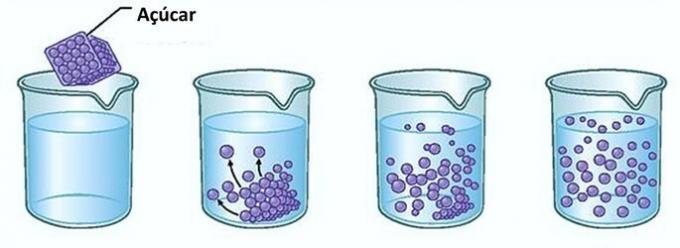
Tomēr, ja jūs turpināsiet pievienot cukuru, jūs atradīsit, ka kādā brīdī tas sāks uzkrāties glāzes apakšā.
Tas ir tāpēc, ka ūdens, kas ir šķīdinātājs, ir sasniedzis šķīdība un maksimālais koncentrācijas daudzums. Tiek saukta izšķīdusī viela, kas paliek trauka apakšpusē un nešķīst fona korpuss.
Cukura pārpalikums stikla apakšā nešķīst un neietekmēs šķīduma koncentrāciju. Turklāt glāzes apakšā nogulsnētais cukurs nepadarīs ūdeni saldāku.
Risinājumu klasifikācija
Šķīdumus var klasificēt pēc izšķīdušās izšķīdušās vielas daudzuma. Tādējādi tie var būt trīs veidu: piesātināti, nepiesātināti un pārsātināti.
- piesātināts šķīdums: Šķīdums ir sasniedzis šķīdības koeficienta robežu, tas ir, noteiktā temperatūrā šķīdinātājā ir izšķīdināts maksimālais izšķīdušās vielas daudzums.
- nepiesātināts šķīdums: Izšķīdušās izšķīdušās vielas daudzums vēl nav sasniedzis šķīdības koeficientu. Tas nozīmē, ka var pievienot vairāk izšķīdušās vielas.
- pārsātināts šķīdums: Izšķīdušās izšķīdušās vielas ir vairāk nekā normālos apstākļos. Šajā gadījumā tie rada nogulsnes.
Lai uzzinātu vairāk par risinājumiem, izlasiet šādus tekstus.:
- Šķīdumu atšķaidīšana
- Molalitāte
- Molaritāte
- Titrēšana
Risinājumu koncentrācija
Pēc izšķīdušās vielas un šķīdinātāja ir iespējams aprēķināt šķīduma koncentrāciju.
Kopējo koncentrāciju definē kā izšķīdušās vielas masas attiecību, kas izšķīdināta noteiktā šķīduma tilpumā.
Koncentrācijas aprēķins tiek veikts, izmantojot šādu formulu:
Būt,
Ç: Koncentrācija (g / L);
mizšķīdušās vielas masa (g);
V: šķīduma tilpums (L).
Piemērs:
(Faap) Aprēķina nātrija nitrāta ūdens šķīduma koncentrāciju g / l, kas satur 30 g sāls 400 ml šķīduma:
Izšķirtspēja:
Ievērojiet informāciju par izšķīdušās vielas un šķīdinātāja daudzumu. 400 ml ūdens šķīduma (šķīdinātāja) ir 30 g sāls (izšķīdis).
Tomēr tilpums ir ml, un mums tas jāpārveido par L:
Tagad, lai uzzinātu koncentrāciju, jums vienkārši jāpielieto formula:
Ar šo rezultātu mēs nonācām pie secinājuma, ka, sajaucot 30 g sāls ar 400 ml ūdens, mēs iegūsim šķīdumu ar koncentrāciju 75 g / L.
Lai iegūtu vairāk informācijas par kopējās koncentrācijas aprēķināšanu, šie teksti būs noderīgi.:
- Risinājuma koncentrācija
- Vingrinājumi par kopēju koncentrēšanos