Virsmas spriedze ir parādība, kas rodas uz šķidrumu, piemēram, ūdens virsmas, veidojot plānu plēvi.
Kad ūdens šķidrā stāvoklī aizņem trauku, mēs varam uztvert šķirtni no šķidruma un vides. Tas ir tāpēc, ka mijiedarbība starp ūdens molekulām uz virsmas atšķiras no mijiedarbības šķidruma iekšienē.
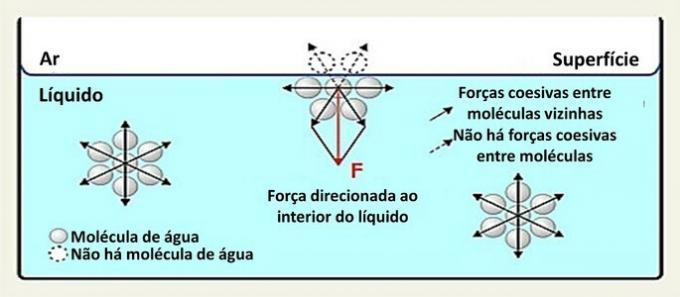
Uz virsmas ūdens molekula mijiedarbojas ar molekulām sānos un zem tās. Iekšpusē molekulu ieskauj citas molekulas, un caur ūdeņraža saitēm notiek mijiedarbība visos virzienos.
Tieši šīs īpašības dēļ mēs novērojam pilienu veidošanās fenomenu. Tādēļ kukaiņiem ir iespējams staigāt arī pa ūdeni.
Kas ir virsmas spraigums?
Tas ir plānas plēves veidošanās zem šķidruma, pateicoties pievilcību nevienlīdzībai starp molekulām, kas to veido. Šī parādība ir izteiktāka šķidrumos, kuriem ir starpmolekulāri spēki intensīva, piemēram, ūdens.
Mijiedarbību starp sugām šķidrumā sauc par saliedējošiem spēkiem. Kamēr molekulas šķidruma iekšienē visos virzienos pievelk kaimiņu molekulas, uz virsmas esošās molekulas mijiedarbojas ar molekulām zem un blakus.
Skatiet, kā virsmas spraigums rodas ūdenī.
Ūdens (H2O) ir polāra molekula, ko veido 2 ūdeņraža atomi (pozitīvie stabi) un viens skābekļa atoms (negatīvais pols), kurus savieno kovalentās saites. Molekulas pozitīvo polu piesaista kaimiņu molekulas negatīvais pols, veidojot ūdeņraža saites.
Šāda veida mijiedarbība šķidrumā tiek izplatīta visos virzienos. Virspusē spēki ir vērsti uz leju un uz sāniem, jo virs tiem nav ūdens molekulu. Tas padara virsmas molekulas saliedētākas un izveido elastīgu plēvi.
Virsmas spraiguma vienību izsaka ar koeficientu starp spēka vienību un garuma vienību, vispieņemtākā ir dyna / centimetrs (dyna / cm) un ņūtons / metrs (N / m).
Ūdenim ir augsts virsmas spraigums, kura vērtība ir 72,75 dyna / cm. Tomēr dzīvsudraba, šķidra metāla, virsmas spraigums ir aptuveni 7 reizes lielāks nekā ūdenim, 475 dyna / cm.
Vai vēlaties uzzināt vairāk? Tāpēc pārbaudiet šādus tekstus:
- Ūdens īpašības
- Polārās un apolārās molekulas
- Ķīmiskās saites
Parādības, ko izraisa virsmas spraigums
Virsmas spriedze ir atbildīga par dažām parādībām, kuras mēs novērojam ikdienā. Galvenie no tiem ir:
Dzīvnieki, kas staigā pa ūdeni

Kukaiņi, zirnekļi un citi dzīvnieki var staigāt vai atpūsties Ūdens jo uz ķepu ekstremitātēm ir matiņi, kas pārklāti ar taukainu vielu, un tāpēc tie nevar iekļūt starp ūdens molekulām, kas ir savienotas uz virsmas.
Ūdens pilienu veidošanās

Ūdens pilieni ir sfēriski, pateicoties ūdenstilpes saraušanās procesam molekulas virsmas spraiguma dēļ. Sfēra rodas tāpēc, ka šī ir ģeometriskā forma, kurā ir vismazākā saikne starp virsmas laukumu un tilpumu. Tāpēc sfēriskā forma uztur vismazāko daudzumu ūdens molekulu, kas nonāk saskarē ar gaisu.
Vingrinājumi ūdens virsmas spraigumam
1. Virsmaktīvā viela ir viela, kas iedarbojas uz citu, lai mainītos:
a) Osmolaritāte.
b) virsmas spraigums.
c) Elektroforēze.
d) viskozitāte.
e) Osmotiskais spiediens.
Pareiza alternatīva: b) virsmas spraigums.
a) nepareizi. Osmolaritāte ir saistīta ar izšķīdušās daļiņas daudzumu, kas atrodas noteiktā šķīdinātāja tilpumā.
b) PAREIZI. Gan mazgāšanas līdzekļi, gan ziepes pazemina ūdens virsmas spraigumu, un tos parasti sauc virsmaktīvās vielas, jo šo materiālu molekulas ir izvietotas starp ūdens molekulām un samazina spriedzi virspusējs.
c) nepareizi. Elektroforēze ir paņēmiens molekulu atdalīšanai pēc to lādiņiem.
d) nepareizi. Viskozitāte ir fiziska īpašība, kas nosaka šķidruma pretestību plūsmai.
e) nepareizi. Osmotiskais spiediens ir koligatīvs īpašums, kas atbilst spiedienam, kas jāpieliek sistēmai, lai novērstu osmozes spontānu rašanos.
Uzziniet vairāk par šajā izdevumā apskatītajiem jautājumiem:
- Matērijas īpašības
- Koligatīvās īpašības
- Osmotiskais spiediens
2. Šķidrumu virsmas spraigums ir tieši atkarīgs no mijiedarbības procesiem starp molekulām, piemēram, no ūdeņraža savienojuma, piemēram. Kurai no zemāk redzamajām vielām ir visaugstākais virsmas spraigums?
a) benzols
b) oktānskaitlis
c) etilspirts
d) tetrahlorogleklis
e) etānskābe
Pareiza alternatīva: e) etānskābe.
a) nepareizi. Benzols ir ogļūdeņradis, nepolāra molekula un neveido ūdeņraža saites.
b) nepareizi. Oktāns ir ogļūdeņradis, un tāpēc tas ir nepolāra molekula, kas neveido ūdeņraža saites.
c) nepareizi. Etilspirts ir nedaudz polārs savienojums, kas var veidot ūdeņraža saites, bet mijiedarbība starp molekulām ir ierobežota.
d) nepareizi. Oglekļa tetrahlorīds ir nepolārs organiskais savienojums, un tāpēc tas neveido ūdeņraža saites.
e) PAREIZI. Karbonskābes funkcionālā grupa (-COOH) var izveidot ūdeņraža saites vai nu ar skābekli, vai ar hidroksilūdeņradi.

Uzziniet vairāk par šajā izdevumā apskatītajiem jautājumiem:
- Molekulu polaritāte
- Organiskās funkcijas
- Ogļūdeņraži
virsmas spraiguma eksperiments
Noskatieties video zemāk ar eksperimentu, kas parāda ūdens virsmas spraigumu.