Teksts Titrēšana parādīja, kā tiek veikta šī tilpuma analīzes tehnika, kuras galvenais mērķis ir identificē šķīduma koncentrāciju, reaģējot ar citu zināmas koncentrācijas šķīdumu.
Tagad mēs redzēsim, kā izmantot titrēšanā iegūtos datus, lai sasniegtu vēlamo koncentrāciju, kas var būt skābe vai bāze šķīdumā. Lai to izdarītu, pamatā ir trīs darbības:
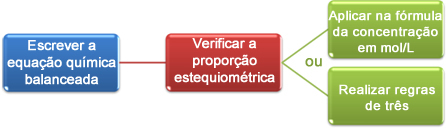
Apskatīsim piemēru:
Pieņemsim, ka ķīmiķim bija etiķskābes (etiķa (CH3COOH(šeit))) un vēlējās noskaidrot tā koncentrāciju mol / L. Tad viņš ievietoja 20,0 ml etiķa (titrēts) Erlenmeijera kolbā un pievienoja fenolftaleīna indikatoru. Tad viņš piepildīja 100 ml bireti ar zināmas koncentrācijas (titranta) nātrija hidroksīdu (NaOH), kas vienāds ar 1,0 mol / L. Visbeidzot, ķīmiķis veica titrēšanu un pamanīja, ka krāsas maiņa (pagrieziena punkts - kad viņš pārtrauca titrēšanu) notika, kad tika patērēts 24 ml NaOH.

Pamatojoties uz šo eksperimentu, viņš ieguva šādus datus:
MCH3COOH= ?
VCH3COOH = 20 ml = 0,02 L
MNaOH = 24 ml = 0,024 L
VNaOH = 1,0 mol / l
Kur M = koncentrācija mol / L un V = tilpums L
Lai uzzinātu etiķskābes koncentrāciju, mums vispirms jāzina, kā uzrakstīt ķīmisko vienādojumu, kas atspoguļo notikušo pareizi sabalansēto neitralizācijas reakciju. Šajā gadījumā reakcija ir šāda:
1 CH3COOH(šeit) + 1 NaOH(šeit) → 1 NaC2H3O2 (aq) + 1 stunda2O(ℓ)
Šī daļa ir svarīga, lai redzētu stehiometrisko attiecību, kādā reaģenti reaģē. Ņemiet vērā, ka attiecība ir 1: 1, tas ir, katram etiķskābes molam ir nepieciešams 1 mols nātrija hidroksīda.
Tagad mēs varam turpināt aprēķinus divos veidos:
(1.) Izmantojot formulu: M1. V1 = M2. V2
Tā kā stehiometriskā attiecība ir 1: 1, mums ir: NēCH3COOH = nNaOH .
Būt M = n / V → n = M. V. Tādējādi mēs nonākam pie iepriekš minētā saraksta, kuru šajā gadījumā var rakstīt šādi: MCH3COOH. CH3COOH = MNaOH. VNaOH
Tātad, vienkārši aizstājiet šīs formulas vērtības:
MCH3COOH. V CH3COOH = MNaOH. VNaOH
MCH3COOH. 0,02 L = 1,0 mol / L. 0,024 l
MCH3COOH = 0,024 mol
0,02 l
MCH3COOH = 1,2 mol / l
Tāpēc etiķskābes šķīduma sākotnējā koncentrācija, mūsu nosaukums, bija 1,2 mol / l.
Svarīga piezīme: Ja stehiometriskā attiecība nebūtu 1: 1, būtu pietiekami reizināt vielu koncentrāciju mol / L (M) ar to attiecīgajiem koeficientiem. Piemēram, ja attiecība būtu 1: 2, mums būtu šādi:
M1. V1 = 2. M2. V2
Bet šeit ir vēl viens veids, kā veikt šos aprēķinus:
(2.) Izmantojot trīs noteikumus:
1 CH3COOH(šeit) + 1 NaOH(šeit) → 1 CH3COONa(šeit) + 1 stunda2O(ℓ)
1 mol 1 mol 1 mol 1 mol
1. 60g 1. 40 g 1. 82 g 1. 18 g
Šīs masas ir aprēķinātās molekulmasas katrai vielai.
* Zinot, ka izlietotais 1,0 mol / L NaOH šķīduma tilpums(šeit) bija 24 ml, vispirms mēs varam uzzināt NaOH vielas daudzumu (mol), kas reaģēja:
1 mol NaOH → 1,0 L
1 mol NaOH 1000 ml
x 24 ml
x = 0,024 mol NaOH
* Tā kā attiecība ir 1: 1, etiķskābes vielas daudzumam (mol) jābūt tādam pašam kā NaOH: 0,024 mol.
Novērojums: Ja stehiometriskā attiecība būtu atšķirīga, mēs to šajā daļā ņemtu vērā. Piemēram, ja tas būtu 1: 3 un vienas ķīmiski reaktīvās sugas vielas daudzums būtu vienāds ar 0,024 mol, tad citas vielas daudzums būtu trīskāršs: 0,072.
* Tagad mēs aprēķinām:
20 ml etiķa 0,024 mol etiķskābes
1000 ml etiķa un
y = 1,2 mol
Tas ir, ir 1,2 mol / L, kas ir tāda pati vērtība, kādu ieguvām iepriekšējā metodē.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/calculos-envolvidos-na-titulacao.htm

