Organiskās reakcijas ir reakcijas, kas notiek starp organiskiem savienojumiem. Ir vairāki reakciju veidi, kas notiek, sadalot molekulas, radot jaunas saites.
Plaši izmanto rūpniecībā, tieši no tiem var ražot zāles un kosmētikas produktus, plastmasu, cita starpā.
galvenais organisko reakciju veidi viņi ir:
- pievienošanas reakcija
- aizstājējreakcija
- eliminācijas reakcija
- Oksidācijas reakcija
Papildinājuma reakcija
Pievienošanas reakcija notiek, kad organiskās molekulas saites saraujas un tai pievieno reaģentu.
Tas notiek galvenokārt savienojumos, kuru ķēdes ir atvērtas un kuriem ir nepiesātinājumi, piemēram, alkēnos () un alkīni (
).
Pievienošanas reakciju piemēri
1. piemērs: hidrogenēšana (ūdeņraža pievienošana)
Hidrogenējot alkēnu, rodas alkāns.
2. piemērs: halogenēšana (halogēnu pievienošana)
Halogenējot alkēnu, rodas halogenīds.
3. piemērs: mitrināšana (ūdens pievienošana)
Alkēna hidratācija rada spirtu.
Lasiet arī: Organiskie savienojumi
Aizstāšanas reakcija
Aizstāšanas reakcija notiek, ja ir saistošie atomi (vai grupa), kurus aizstāj citi.
Tas notiek galvenokārt alkānu, ciklānu un aromātisko vielu vidū.
Aizstāšanas reakciju piemēri
1. piemērs: halogenēšana (halogēna aizvietošana)
Halogenējot alkānu, rodas halogenīds.
2. piemērs: nitrēšana (aizvietošana ar nitro)
Alkāna nitrēšana rada nitro savienojumu.
3. piemērs: sulfonēšana (aizstāšana ar sulfoniku)
Alkāna sulfonēšana rada skābi.
Lasiet arī: Organiskās funkcijas
Eliminācijas reakcija
Eliminācijas reakcija notiek, kad no organiskās molekulas tiek noņemts oglekļa ligands.
Šī reakcija ir pretrunā pievienošanas reakcijai.
Eliminācijas reakciju piemēri
1. piemērs: ūdeņraža atdalīšana (dehidrogenēšana)
Ūdeņraža atdalīšana no alkāna rada alkēnu.
2. piemērs: halogēnu atdalīšana (de-halogenēšana)
Halogēnu atdalīšana no dihalīda rada alkēnu.
3. piemērs: halogenīdu eliminācija
Noņemot halogenīdu no halogenīda, rodas alkēns.
4. piemērs: ūdens izvadīšana (alkohola dehidratācija)
Ūdens noņemšana no spirta rada alkēnu.
Skatiet arī: Esterifikācija
Oksidācijas reakcija
Oksidācijas reakcija, ko sauc arī par redoksu, notiek, kad notiek elektronu pieaugums vai zudums.
Oksidācijas reakciju piemēri
1. piemērs: enerģētiska alkēnu oksidēšana
Alkēna enerģētiskā oksidēšana rada karbonskābes.
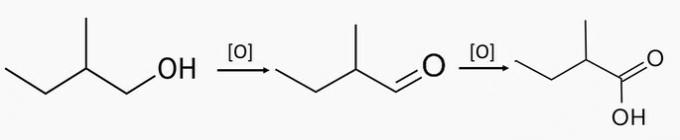
2. piemērs: primārā alkohola oksidēšanās
Primārā spirta enerģētiskā oksidēšana rada karbonskābi un ūdeni.
3. piemērs: sekundārā spirta oksidēšanās
Sekundārā spirta oksidēšana rada ketonu un ūdeni.
Lasiet arī: Karboksilskābes
Organisko reakciju vingrinājumi
jautājums 1
(Unifesp / 2002) Daudzus spirtus var iegūt ar skābju katalizētu alkēnu hidratāciju.
Šajā pievienošanas reakcijā ūdenī esošais H tiek pievienots ogleklim, kuram ir pievienots vairāk ūdeņražu, un hidroksilgrupa ir piesaistīta mazāk hidrogenētajam ogleklim (Markovņikova likums).
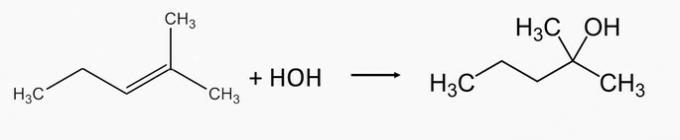
Zinot, ka divu alkēnu hidratācijā izveidojušies spirti ir attiecīgi 2-metil-2-pentanols un 1-etilciklopentanols, kā sauc attiecīgos alkēnus, kas tos izraisīja?
a) 2-metil-2-pentēns un 2-etilciklopentēns.
b) 2-metil-2-pentēns un 1-etilciklopentēns.
c) 2-metil-3-pentēns un 1-etilciklopentēns.
d) 2-metil-1-pentēns un 2-etilciklopentēns.
e) 3-metil-2-pentēns un 2-etilciklopentēns.
Pareiza alternatīva: b) 2-metil-2-pentēns un 1-etilciklopentēns.
2-metil-2-pentanola spirtu ražo, hidratējot 2-metil-2-pentēna alkēnu.
1-etilciklopentanola spirtu iegūst, hidratējot 1-etilciklopentēna alkēnu.
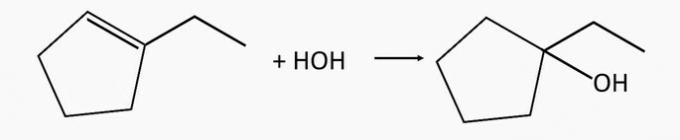
2. jautājums
(Ufal / 2000) Pētot oglekļa savienojumu ķīmiju, tiek uzzināts, ka BENZENE:
() Tas ir ogļūdeņradis.
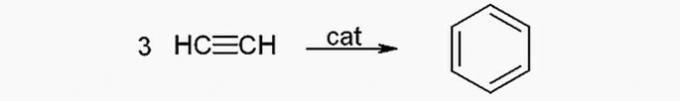
() Var iegūt no acetilēna.
() Eļļā tā ir lielāka masas daļa.
() Var iziet aizstāšanas reakciju.
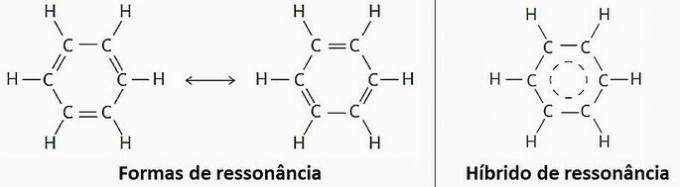
() Tas ir molekulārās struktūras piemērs, kas rada rezonansi.
(TRUE) Benzols ir aromātisks ogļūdeņradis. Šo savienojumu veido tikai oglekļa un ūdeņraža atomi, kuru formula ir C6H6.
(TRUE) Benzolu no acetilēna var iegūt, izmantojot šādu reakciju:
(FALSE) Nafta ir ogļūdeņražu maisījums, un sastāvdaļu masa ir saistīta ar ķēdes lielumu. Tāpēc lielākām oglekļa ķēdēm ir lielāka masa. Smagākajās naftas frakcijās, piemēram, asfaltā, ir ķēdes ar vairāk nekā 36 oglekļa atomiem.
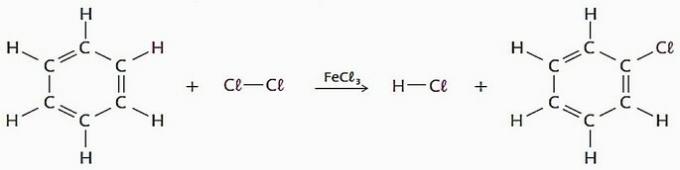
(PATIESA) Aizstāšanas reakcijām, izmantojot benzolu kā reaģentu, ir daudz rūpniecisku pielietojumu, galvenokārt zāļu un šķīdinātāju ražošanai.
Šajā procesā ūdeņraža atomu var aizstāt ar halogēniem, nitrogrupu (-NO2), sulfongrupa (—SO3H), cita starpā.
Skatiet šāda veida reakcijas piemēru.
(PATIESA) Rezonanses dēļ benzolu var attēlot ar divām strukturālām formulām.
Tomēr praksē ir novērots, ka starp oglekļa atomiem izveidoto saišu garums un enerģija ir vienādi. Tāpēc rezonanses hibrīds ir vistuvāk reālajai struktūrai.
3. jautājums
(UFV / 2002) Alkohola oksidēšanās reakcija ar molekulāro formulu C5H12O ‚ar KMnO4 nodrošināja savienojumu ar molekulas formulu C5H10O.
Pārbaudiet opciju, kas parāda PAREIZU korelāciju starp spirta nosaukumu un izveidotā produkta nosaukumu.
a) 3-metilbutan-2-ols, 3-metilbutanāls
b) pentān-3-ols, pentān-3-ons
c) pentān-1-ols, pentān-1-ons
d) pentān-2-ols, pentanāls
e) 2-metilbutan-1-ols, 2-metilbutan-1-ons
Pareiza alternatīva: b) pentān-3-ols, pentān-3-ons.
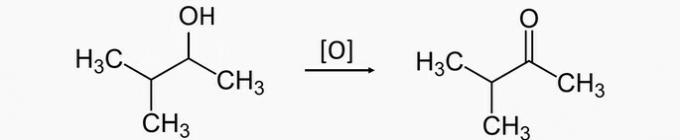
a) nepareizi. Sekundārā spirta oksidēšana rada ketonu. Tāpēc pareizais produkts 3-metilbutan-2-ola oksidēšanai ir 3-metilbutan-2-ons.
b) PAREIZI. Sekundārā pentan-3-ola oksidēšana rada pentan-3-onketonu.

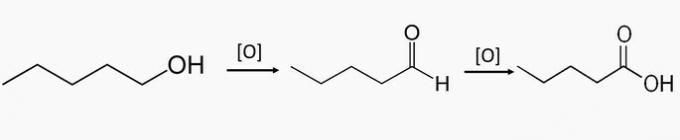
c) nepareizi. Šie savienojumi ir daļa no primāro spirtu oksidēšanas, kas rada aldehīdu vai karbonskābi.
Pentan-1-ols ir primārais spirts, un daļēji savienojot oksidējot savienojumu, var veidoties pentanāls un pilnīgas oksidēšanās rezultātā veidoties pentānskābe.
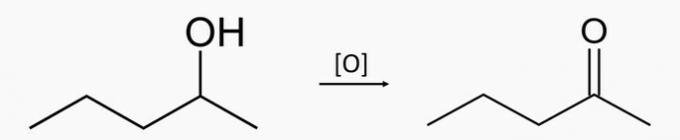
d) nepareizi. Sekundārā spirta pentān-2-ola oksidēšana rada pentan-2-onketonu.
e) nepareizi. Primārais spirts 2-metilbutan-1-ols daļējā oksidācijā ražo 2-metilbutanālu aldehīdu un kopējā oksidācijā - 2-metilbutānskābi.
4. jautājums
(Makenzijs / 97) Eliminācijas reakcijā, kas notiek 2-brombutānā ar kālija hidroksīdu spirta vidē, iegūst divu organisko savienojumu, kas ir pozīcijas izomēri, maisījumu.
Viens no tiem, kas veido mazāku daudzumu, ir 1-butēns. Otrs ir:
a) metilpropēns.
b) 1-butanols.
c) butāns.
d) ciklobutāns.
e) 2-butēns.
Pareiza alternatīva: e) 2-butēns.
Alkēnus ražo organiskā halogenīda HBr reakcijā ar kālija hidroksīdu KOH, etilspirta kā šķīdinātāja klātbūtnē.

Dažādi savienojumi tika izveidoti, jo halogēna atoms atrodas oglekļa ķēdes vidū, radot vairāk nekā vienu eliminācijas iespēju.
Lai gan ir divas produktu iespējas, tiem nebūs vienādu daudzumu.
2-butēns šai reakcijai tiks izveidots lielākā daudzumā, jo tas rodas no terciārā oglekļa atdalīšanas. 1-butēns veidojās, atdalot primāro oglekli, un tāpēc veidojās mazāks daudzums.

