Jūs oksīdi tos veido divi dažādi elementi, no kuriem viens ir skābeklis, kuram jābūt visvairāk elektronegatīvam no šiem diviem.
Neorganisko oksīdu nomenklatūrā ievēroti noteikumi, kas ir atkarīgi no tā, vai oksīds ir molekulārs, kovalents vai jonu. Apskatīsim katru gadījumu:
* Molekulāro oksīdu vai kovalentā tīkla nomenklatūra:
Molekulārie vai kovalenti tīkla oksīdi ir tie, kuriem skābeklis ir piesaistīts a ametal, piemēram, ogleklis (C), slāpeklis (N), sērs (S), fluors (F). Šo oksīdu nomenklatūrā ievērots šāds noteikums:

Nomenklatūras noteikums oksīdiem, kas veidoti ar ametāliem
Mono prefikss ar skābekli saistītā elementa priekšā nav obligāts.
Piemēram, mums ir šāds molekulārais oksīds: CO.
- prefikss, kas norāda skābekļa daudzumu: 1 skābeklis: mono;
- oksīds;
- prefikss, kas norāda otra elementa atomu skaitu: 1 ogleklis: mono;
- ar skābekli saistītā elementa nosaukums: ogleklis.
Tātad, jūsu vārds ir šāds: CO = monoglekļa monoksīds vai oglekļa monoksīds.
Skatīt citus piemērus:
oglekļa dioksīds - CO
2Sēra trioksīds - SO3
Dihlorheptoksīds - Cl2O7
Dinitrogēna monoksīds - N2O
Dinitrogēna trioksīds - N2O3
Slāpekļa monoksīds -NO
Slāpekļa dioksīds - NĒ2
Dinitrogēna pentoksīds - N2O5
Silīcija dioksīds - SiO2
Difosfora pentoksīds - P2O5
Sēra trioksīds - SO3
* Jonu oksīdu nomenklatūra:
Jonu oksīdi ir tie, kuriem skābeklis ir saistīts ar a metāls, piemēram, dzelzs (Fe), svins (Pb), nātrijs (Na), kalcijs (Ca), sudrabs (Ag). Parasti skābekļa elektriskais lādiņš ir -2.
Molekulāro vai kovalento tīkla oksīdu nomenklatūra šobrīd tiek piemērota arī metāla oksīdiem un tiek uzskatīta par oficiālu. Skatiet dažus piemērus:
Dzelzs monoksīds - FeO
Svina monoksīds - PbO
Svina dioksīds - PbO2
Difūzs trioksīds - Fe2O3
Tomēr pastāv īpaša metālu oksīdu nomenklatūra, kas joprojām tiek plaši izmantota. Tās pamatā ir ar skābekli saistītā elementa valence.
Ja elementam ir viena valence, tas ir, ja ir tikai viens veids, kā saistīt skābekli un veidot tikai viena veida oksīdu, nosaukuma noteikumu sniegs:

Viena valenta jonu oksīda nosaukšanas noteikums
Piemēri:
- nātrija oksīds - Na2O
- kalcija oksīds - CaO
- kālija oksīds - K.2O
- alumīnija oksīds - Al2O3
- sudraba oksīds - Ag2O
Bet ir arī jonu oksīdi, ko veido elementi ar vairāk nekā viena valence. Šādos gadījumos nosaukuma noteikums ir šāds:
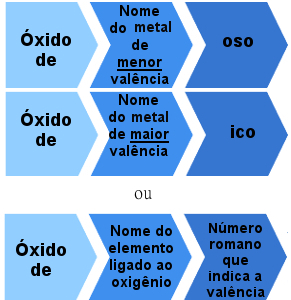
Nomenklatūras noteikums jonu oksīdiem ar vairāk nekā vienu valenci
Piemēri:
Dzelzs oksīds - FeO
Dzelzs oksīds - Fe2O3
Vara oksīds - Cu2O
vara oksīds - CuO
Vai arī:
Dzelzs oksīds II - FeO (dzelzs oksīds = +2)
Dzelzs oksīds III - Fe2O3 (Dzelzs nox = +3).
Vara oksīds I - Cu2O (dzelzs nox = +1)
II vara oksīds - CuO (dzelzs nox = +2).
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/nomenclatura-dos-oxidos.htm
