definē sevi kā hibridizācija nepilnīgu atomu orbitāļu savienojums. Orbitāle tiek klasificēta kā nepilnīga, ja tai ir tikai viena elektrons tā iekšpusē divu vietā. Skatiet nepilnīgas orbītas un pilnīgas orbitāles attēlojumu:

A attēlā mums ir pilnīga orbīta; attēlā B - nepilnīga orbitāle.
Hibridizācija ir dabiska parādība, kas notiek ar dažiem ķīmiskiem elementiem, piemēram, fosforu, sēru, oglekli utt. Oglekļa hibridizācija ļauj šī elementa atomiem izveidot četras ķīmiskās saites, tas ir, ogleklis pēc hibridizācijas fenomena izveido tikai četras saites.
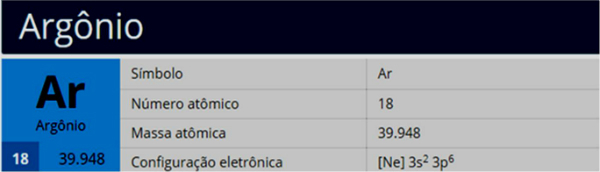
Bet kāpēc ogleklis hibridizējas un izveido četras saites? Lai saprastu šo parādību, mums jāzina šī elementa elektroniskā izplatīšana:
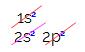
Elektroniskajā oglekļa sadalījumā mēs redzam, ka 1s apakšlīmenis ir pabeigts (ar diviem elektroniem), 2s ir pilnīgs (ar diviem elektroniem) un 2p apakšlīmenis ir nepilnīgs (p apakšlīmenis atbalsta sešus elektronus, bet ir tikai divi). Izplatot 2p elektronus reprezentatīvā veidā, mums:
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
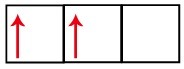
P apakšlīmenim ir trīs orbitāles - oglekļa gadījumā divas no tām ir nepilnīgas un viena ir tukša. Šī iemesla dēļ šim elementam vajadzētu veikt tikai divas saites, jo nepilnīgu orbitāļu skaits vienmēr nosaka saišu skaitu.
Tomēr, saņemot enerģiju no ārējās vides, ogleklī esošie elektroni ir satraukti. Tādējādi viens no elektroniem, kas atrodas 2. apakšlīmenī, pāriet uz p apakšlīmeņa orbitāli, kas bija tukša:
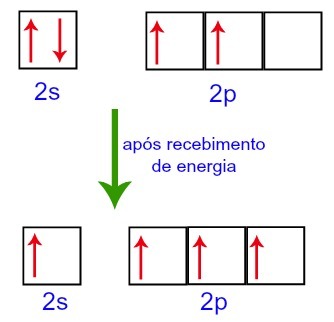
Oglekļa orbītas pirms un pēc enerģijas saņemšanas no ārējās vides
Tādējādi ogleklim otrajā līmenī paliek četras nepilnīgas orbitāles. Tad 2s apakšlīmeņa orbitāle savieno trīs p orbitāles, kas konfigurē parādību hibridizācija.
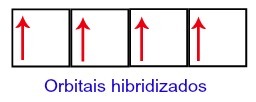
Oglekļa orbitāles pēc hibridizācijas
Autors: Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Oglekļa hibridizācija"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm. Piekļuve 2021. gada 28. jūnijam.