Jūs Ogļūdeņraži ir sastādījuši ogleklis (C) un ūdeņradis (H). Oglekļa elastība, kas ir šo savienojumu galvenais elements, veicina milzīgu struktūru daudzveidību Tāpēc dažas īpašības, piemēram, kušanas un viršanas temperatūra, var atšķirties starp vienu ogļūdeņražu un citu.
Tās galvenokārt ir molekulas apolārs, ar spēkss starpmolekulāri izraisīts dipola tips un blīvums mazāks par The no ūdens. Šos savienojumus var identificēt, izmantojot nomenklatūru, kas atbilst Starptautiskās tīras un lietišķās ķīmijas savienības (Iupac) izstrādātajiem noteikumiem.
Lasiet arī: Ogleklis - viens no visbagātīgākajiem Visuma elementiem
Ogļūdeņražu īpašības

Polaritāte: ogļūdeņraži bez heteroatomu klātbūtnes ir apolārs.
Starpmolekulārie spēki: saites starp ogļūdeņraža molekulām ir šāda veida izraisīts dipols.
kušanas temperatūra unvārīšanās: tie mainās atkarībā no molekulas lieluma, funkcijas un strukturālās organizācijas.
fiziskais stāvoklis: normālos temperatūras un spiediena apstākļos ogļūdeņraži ar četriem vai mazākiem oglekļa atomiem ir gāzveida stāvoklī. Tie, kuriem ir 5 līdz 17 ogļūdeņraži, ir šķidrā stāvoklī, un ogļūdeņraži ar vairāk nekā 17 ogļūdeņražiem ir cietas vielas.
Blīvums: ir mazāks par blīvums ūdens, ti, mazāk par 1,0 g / cm³.
Reaktivitāte: alifātiskie un nepiesātinātie ogļūdeņraži ir slikti reaģējoši; nepiesātinātie savienojumi, visticamāk, reaģēs ar citām molekulām, un cikliskie ogļūdeņraži ar ne vairāk kā pieciem ogļūdeņražiem ir ļoti reaktīvi.
Ogļūdeņražu klasifikācija
Ogļūdeņraži var klasificēt pēc ķēdes strukturālās organizācijas un iestādes.Nepiesātinājums ir dubultās (-o) vai trīskāršās saites klātbūtne starp oglekļiem, ir pi tipa savienojumi (π). jau zari tie ir kā “zari”, kas piestiprināti pie lielākas ogļūdeņraža struktūras. Cikliskās ķēdes var saturēt arī zarus un / vai nepiesātinājumus - slēgtas ķēdes ogļūdeņražu strukturālā organizācija veido daudzstūrus, piemēram, kvadrātu, trijstūri, heksānu.
Attiecībā uz atomu izvietojumu ogļūdeņradim var būt normāla vai sazarota ķēde.
→ C ogļūdeņradisnormāla, lineāra vai taisna: tā, kurai ir virkne, kurai ir tikai divi gali.

→ C ogļūdeņradisienīst sazarota: tā, kurai ir ķēde, kurai ir vairāk nekā divi gali. Lai uzzinātu, kur un kādi ir zari, ir svarīgi pareizi izvēlēties galveno ķēdi. Galvenajā ķēdē jābūt visiem nepiesātinātajiem un heteroatomiem (ja tādi ir), kā arī vislielākais secīgo ogļu skaits. Ogles, kas nav galvenajā ķēdē, ir zari.
Piemērs:

Attiecībā uz tā "aizvēršanu" ogļūdeņradim var būt slēgta, atvērta vai jaukta ķēde.
→ Ķēdes ogļūdeņražis slēgts vai ciklisks: tie ar ķēdēm, kurās atomi organizējas, veidojot ciklu, daudzstūri vai aromātisku gredzenu (slēgts ogļūdeņradis ar mainīgām nepiesātinājumiem). Nav vaļīgu galu, ja vien nav zara. Katrs daudzstūra virsotne apzīmē oglekli un tā attiecīgos ūdeņraža savienotājus.
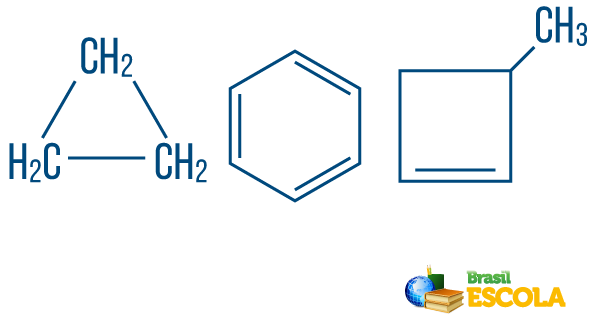
→ Atvērtas ķēdes vai acikliskie ogļūdeņraži: ir ķēdes ar vismaz diviem galiem.

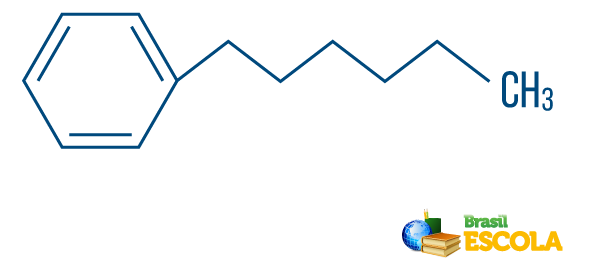
→ Ogļūdeņradis no jaukta tipa virkne: veido gredzens vai cikliska ķēde, kas piestiprināta lineārai daļai; tam ir vismaz viens gals.
Lasiet arī: Aromātiskie ogļūdeņraži - piemēri un īpašības
Ogļūdeņražu nomenklatūra
Katram ogļūdeņražu veidam ir Iupac noteiktais nosaukuma noteikums. Šo savienojumu nomenklatūru veic šādi:
1. daļa: filiāles (-u) atrašanās vieta un nosaukums (ja ir);
2. daļa: attiecas termins cikls ja savienojums ir slēgta ķēde, bet, ja tā ir alifātiska (atvērta) ķēde, tas nebūs vajadzīgs;
3. daļa: prefikss, kas norāda, cik daudz ogļu ir galvenajā ķēdē;
4. daļa: vieta un uzraksts, kas norāda uz nepiesātinājuma veidu molekulā;
5. daļa: piedēklis “o” ogļūdeņražiem.
Ja molekulai ir atvērta struktūra, bez sazarojuma, nomenklatūra sāksies 3. daļā.
Šajā tabulā parādīta nepieciešamā informācija (prefikss, priedēklis un sufikss) ogļūdeņražu nomenklatūrai kopumā. O priedēklis mainās atkarībā no ogļu skaita; O infix, pēc nepiesātinājumu skaita; tas ir sufikss“O " attiecas uz ogļūdeņraža tipa savienojumiem.
Priedēklis |
Infix |
Sufikss |
||
1 ogleklis |
met- |
Tikai atsevišķi zvani |
-un- |
-O |
2 ogles |
et- |
|||
3 ogles |
prop- |
1 dubultā saite |
-en- |
|
4 ogles |
bet- |
|||
5 ogles |
pent- |
2 dubultās saites |
-dien- |
|
6 ogles |
sešstūra- |
|||
7 ogles |
hept- |
1 trīskāršā saite |
-in- |
|
8 ogles |
okt- |
|||
9 ogles |
ne- |
2 trīskāršās saites |
-diin- |
|
10 ogles |
dec- |
Pirmais solis organiskā savienojuma nomenklatūras atklāšanā ir identificēt galveno ķēdi ogļūdeņražiem, kuros jābūt nepiesātinājumiem un pēc iespējas vairāk secīgu ogļu. Pēc galvenās ķēdes noteikšanas ogļi ir jāuzskaita - skaitīšanas sākšana no sāniem, kas ir vistuvāk zariem un nepiesātinājumiem (ja tādi ir). lokalizācija būs oglekļa numurs, kurā atrodas atzars vai nepiesātinājums. Dažreiz radikālajai vai divkāršajai vai trīskāršajai saitei ir tikai viena iespējamā vieta, tāpēc nomenklatūrā nav nepieciešams izteikt saistošā oglekļa atrašanās vietu.

zaru nomenklatūra tiks aprēķināts pēc ogļu skaita katrā, pieskaitot izbeigšanu līnija vai ll. Ja ir vairāk nekā viena filiāle, tiek izmantota alfabētiskā secība.
Skatiet tālāk minētos piemērus:
→ 1. piemērs
CH3 - CH2 - CH3 → Propāns
1. daļa: prefikss “prop-”Norāda, ka ķēdē ir trīs ogles.
2. daļa: papildinājums "-un-”Norāda, ka molekula veido tikai šāda veida savienojumus sigma vai vienkārši.
3. daļa: sufikss "-O”Ir raksturīgs ogļūdeņražiem.
→ 2. piemērs
CH2= CH-CH2-CH3 → But-1-ene
Ogļūdeņražos ar nepiesātinājumu ir nepieciešams numurēt un atrast oglekli, kurā atrodas pāris, un numerācijai jābūt pēc iespējas mazākai. Lai to izdarītu, oglekļa skaitam jāsākas ar pusi, kas ir vistuvāk dubultā saitei.
1. daļa: "bet- ” norāda, ka ķēdē ir četri ogļi.
2. daļa: "1-lv" attiecas uz nepiesātinājumu, kas atrodas starp oglekli 1 un 2.
3. daļa: "-O" ir ogļūdeņražu raksturīgais sufikss.
→ 3. piemērs

1. daļa: "3-etilgrupa" signalizē, ka uz oglekļa 2 ir divu oglekļa atzars.
2. daļa: "pent" norāda piecu ogļu klātbūtni galvenajā ķēdē.
3. daļa: "-an-" ir nepiesātināto ķēžu uzlikums (bez dubultām vai trīskāršām saitēm).
4. daļa: "-O" ir ogļūdeņražu raksturīgais sufikss.
→ 4. piemērs
Ķēdēm ar vairāk nekā viena filiāle, ievietojiet radikāļus nomenklatūrā alfabētiskā secībā. Ja vienā un tajā pašā molekulā ir atzari un nepiesātinājumi, oglekļa daudzums galvenajā ķēdē jāveic tā, lai atrašanās vietas ciparu summa būtu pēc iespējas mazāka.
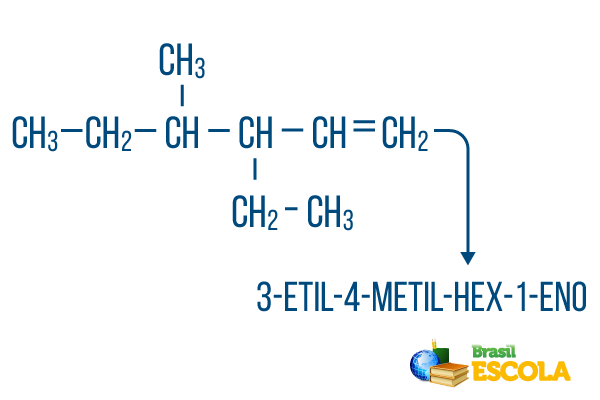
Galvenās ķēdes oglekļa daudzums tika veikts no kreisās uz labo, un nepiesātinājuma un atzarojuma vietas skaitļu summa ir: 1 + 4 + 3 = 8. Ja oglekļa daudzums būtu bijis no labās uz kreiso, saliktā nomenklatūra būtu 4-etil-3-metil-5-eēns, kuru atrašanās vietu summa būtu: 4 + 3 + 5 = 12, kas ir lielāka par citu hipotēzi, tāpēc to nevajadzētu izmantot.
1. daļa: 3-etil-4-metilgrupa atsaucas uz radikāļiem alfabētiskā secībā un to attiecīgajām atrašanās vietām.
2. daļa: sešstūra- nozīmē, ka galvenajā ķēdē ir 6 ogles.
3. daļa: 1-lv norāda uz divkāršās saites klātbūtni uz oglekļa 1.
4. daļa: "-O" ir ogļūdeņražu raksturīgais sufikss.
→ 5. piemērs
Slēgtām virknēm ir nosaukumnoteikumi, bet vārds cikls sākas savienojuma nosaukums, norādot, ka tas ir slēgts vai ciklisks ogļūdeņradis.
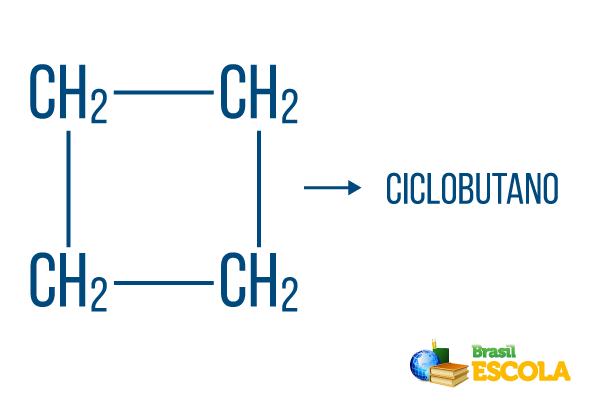
1. daļa: cikls norāda, ka tā ir slēgta virkne.
2. daļa: -bet- apzīmē 4 ogļu esamību ķēdē
3. daļa: -Oir ogļūdeņražu raksturīgais sufikss.
Lasiet arī: Oglekļa ķēžu klasifikācija
Ogļūdeņražu veidi
Ogļūdeņražus var iedalīt alkānos, alkēnos, alkīnos un alkadienos, kurus klasificē kā saskaņā ar ķēdes izveidi (dubultās (-ās) vai trīskāršās saites) - un ciklāni, kas ir ķēdes slēgts.
→ Alkāni: ir ogļūdeņraži, kuriem nav nepiesātinājuma. Alkānu vispārējā formula ir CNēH2n + 2un Nēomenklatūra to sastāda priedēklis + an + O.
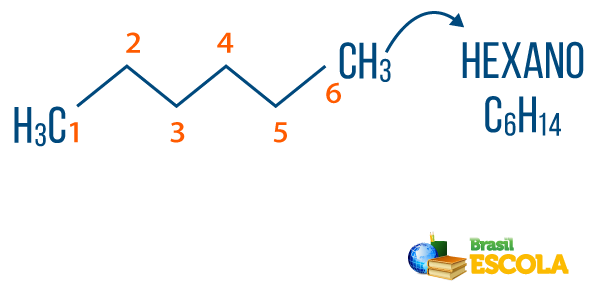
Jūs alkāni var atrast dabā, piemēram, gāze metāns (CH4), ko atbrīvo dzīvnieki un ražo sadalīšanās procesos, kā arī naftas pārstrādes rūpnīcās un naftas ķīmijas rūpniecībā. Savienojumi, piemēram, propāns (Ç3H7), butāns (Ç4H10), kas veido mūsu vārīšanas gāzi (LPG), un oktānskaitlis (Ç8H18), kas atrodas automobiļu degvielā, ir Nafta.

→ alkēni vai alkēni: ir oglekļa ķēdes, kurām ir nepiesātinājums, dubultā saite. Tās vispārējā formula ir CNēH2n, un tavs Nēomenklatūra to sastāda Plabot + lv + o.

O etilēna gāze (Ç2H4), ko izmanto lauksaimniecībā, lai paātrinātu augļu nogatavošanos, pieder funkcijai alkēns. Savienojumu izmanto arī izejvielu ražošanā polietilēns, ko izmanto plastmasas trauku ražošanā.
→ Alkīni vai acetilēnskābi: ogļūdeņraži ar trīskāršu saiti. Tās vispārējā formula ir CNēH2n - 2. nomenklatūra to sastāda prefikss + iekš + o.

O acetilēns vai etīns (C2H2ir alkīna funkcijas gāze, ko izmanto metinājumi un metāla griezumi. Šis savienojums var sasniegt temperatūru līdz 3000 ° C, kas ļauj veikt remontu kuģa iegremdētajās daļās.

→ alkadiēni vai dieni: oglekļa ķēdes ar divām nepiesātinātām, tas ir, divām divkāršām saitēm starp ogļiem. Šīs funkcijas vispārējā formula ir C.NēH2n - 2. Saprotiet, ka tā ir tāda pati formula kā alkīniem, kas nozīmē, ka tā var notikt izomērija starp savienojumiem (viena un tā pati molekulārā formula dažādiem savienojumiem).
Alkadiēna nomenklatūru veido: Plabot + dien + o.
Piemērs:

→ Slēgtas ķēdes ogļūdeņraži: molekulas organizējas cikliskā veidā, tām ir tendence veidot daudzstūri un, tāpat kā atvērtās ķēdēs, var būt izveidošanās un / vai atzarojumi. Cikloni, ciklēni, ciklīni un benzoli ir slēgtas ķēdes ogļūdeņraži.
Cikloni vai cikloalkāni: cikliskas ķēdes, kas sastāv tikai no atsevišķām saitēm. Tās vispārējā formula ir CNēH2n. Nomenklatūra: ciclo + prefikss + an + o.
Cikli vai cikloalkēni: slēgtas ogļūdeņražu ķēdes ar uzņēmumu. Tās vispārējā formula ir CNēH2n-2. Nomenklatūra: çiclo + prefikss + lv + O.
-
Ciklīni vai cikloalkīni: slēgtas ķēdes ogļūdeņraži ar divu dubulto saišu klātbūtni. Tās vispārējā formula ir CNēH2n-4. Nomenklatūra: çiclo + prefikss + iekš + o.
benzolus
Benzols ir slēgtas ķēdes ogļūdeņraža tips ar seši ogļi kur obligācijas mainās starp vienreizēju un divkāršu. Šie savienojumi ir toksisks un ļoti kancerogēns, ko izmanto kā organiskos šķīdinātājus ķīmiskajos procesos.
Lai ogļūdeņradi varētu uzskatīt par aromātisku, jābūt vismaz vienam benzola gredzens, kas ir ļoti reaktīvs, tāpēc pakļauts diviem vai vairāk aizstājēji, ko mēs šeit redzēsim kā atzarus. Kad būs divi savienojošie radikāļi, mums katram pozīciju pārim būs konkrēti nosaukumi.
Radiālie uz 1,2 benzola oglekļiem → orto
Radikāļi pie benzola 1,3 oglekļiem → mērķis
Radiāli uz benzola oglekļa1,4 → priekš
Aromātiskā savienojuma anomenklatūru veic šādi:
1. daļa: ligandu pozicionēšana (orto, mērķis vai uz).
2. daļa: benzolam pievienotā radikāļa vai radikāļu nosaukums (metils, etils, propils…). Radikāļiem piešķirtais nosaukums atbilst citu ogļūdeņražu noteikumam.
- 3. daļa: -Binde, kas ir raksturīgais aromātisko ogļūdeņražu apzīmējums.
Piemēri:
→ Orto-dimetilbenzols

1. daļa: Orto- norāda, ka radikāļi atrodas uz 1. un 2. ogles.
2. daļa: -dimetil- attiecas uz diviem radikāļiem, kuriem abiem ir viens oglekļa atoms.
3. daļa: -benzols ir raksturīgais aromātisko ogļūdeņražu apzīmējums.
→ Ortoetilmetilbenzols
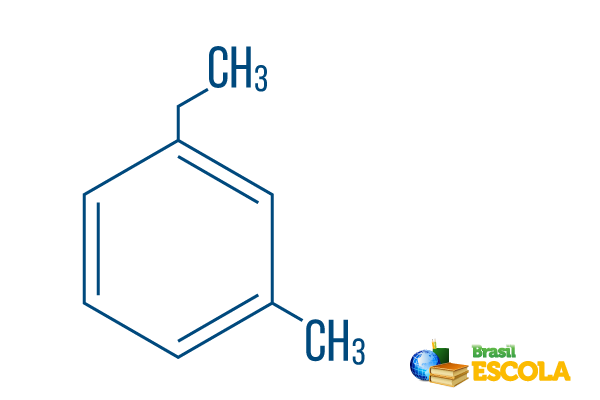
1. daļa: mak- norāda, ka radikāļi atrodas uz 1. un 3. ogles.
2. daļa: etilmetil- attiecas uz oglekļa daudzumu katrā radikāļa būtnē etils The divu oglekļa atzars un metilgrupa sazarojas ar vienu oglekli - nomenklatūrā ievieto alfabētiskā secībā.
3. daļa: -benzols ir raksturīgais aromātisko ogļūdeņražu apzīmējums.
→ para-dietil-benzols
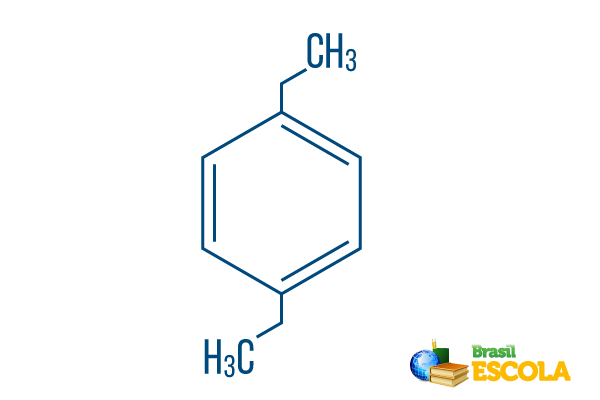
1. daļa: Parkls- norāda, ka radikāļi atrodas uz benzola 1. un 4. ogles.
2. daļa: -dietil- atsaucas uz diviem šāda veida radikāļiem etils, tas ir, divi zari ar diviem ogļiem katrā.
3. daļa: -benzols ir raksturīgais aromātisko ogļūdeņražu apzīmējums.
Lasiet arī:Benzola struktūras atklāšana
atrisināti vingrinājumi
(Unesp) - Oktāns ir viena no galvenajām benzīna sastāvdaļām, kas ir ogļūdeņražu maisījums. Oktāna molekulārā formula ir:
a) C8H18
b) C8H16
c) C8H14
d) C12H24
e) C18H38
Atbilde: a) burts. Analizējot salikto nomenklatūru oktānskaitlis, tas ir alkāns, tas ir, molekula, kas sastāv tikai no atsevišķām saitēm. Ja vispārējā alkānu formula ir CNēH2n + 2, aizstājot “n” ar astoņiem, kas ir ogļu daudzums galvenajā ķēdē - un kas šajā gadījumā ir unikāls -, oktāna molekulārā formula ir C8H18.
(UFSCar-SP) - Apsveriet šādus apgalvojumus par ogļūdeņražiem.
I) Ogļūdeņraži ir organiski savienojumi, kas sastāv tikai no oglekļa un ūdeņraža.
II) Par alkēniem sauc tikai taisnas ķēdes nepiesātinātus ogļūdeņražus.
III) Cikloalkāni ir piesātināti alifātiski ogļūdeņraži ar vispārēju formulu CnH2n.
IV) ir aromātiski ogļūdeņraži: brombenzols, p-nitrotoluols un naftalīns.
Šie apgalvojumi ir pareizi:
a) tikai es un III.
b) tikai I, III un IV.
c) tikai II un III.
d) tikai III un IV.
e) tikai I, II un IV.
Atbilde: Burts a).
II - Alkēni ir savienojumi ar dubultu saiti, tas ir, nepiesātināti, taču to ķēdē var būt atzari, kas nav tikai lineāri.
IV - Brometobenzola un p-nitrotoluola savienojumi pieder citiem organiskās funkcijas.
autors Laysa Bernardes
Ķīmijas skolotājs
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/hidrocarbonetos.htm
