Tekstā "Kā darbojas katalizējošās vielas?”, Ir pierādīts, ka katalizatori spēj palielināt reakcijas ātrumu, jo tie samazina reakcijas rašanās vajadzībām nepieciešamo aktivācijas enerģiju. Viņi to dara, mainot reakcijas mehānismu, apvienojot ar reaģentiem un veidojot starpproduktu savienojumu, kas savukārt kļūst par produktiem un katalizatoru.
Tiek saukts viens no veidiem, kā tas notiek Homogēna katalīze, kas ir tad, kad katalizators ar reaģentiem veido vienfāzes sistēmu.
Tas nozīmē, ka reaģentiem, produktiem un katalizatoriem visiem jābūt vienā fāzē, tas ir, vienā un tajā pašā fiziskā stāvoklī.
Šāda veida katalīzes izpēte ir svarīga zinātnei un rūpniecībai, jo ar nelielu daudzumu katalizatoru var paātrināt vairākas svarīgas ražošanas reakcijas.
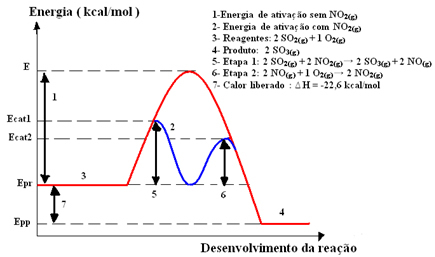
Rūpniecībā izmantotās viendabīgās katalīzes piemērs ir starpposms sērskābes (H2TIKAI4 (aq)), kurā veidojas sēra trioksīds (SO3. punkta g) apakšpunkts) sēra dioksīda (SO2. punkta g) apakšpunkts), parādīts zemāk:
2 SO2. punkta g) apakšpunkts + O2. punkta g) apakšpunkts → 2 OS3. punkta g) apakšpunkts
Šī reakcija norit pārāk lēni, tāpēc tiek pievienots katalizators, slāpekļa dioksīds (NO).2. punkta g) apakšpunkts). Šis katalizators kopā ar sēra dioksīdu veido starpproduktu savienojumu (aktivēto kompleksu), kas ir slāpekļa monoksīds (NOg)).
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Tad šis starpprodukta savienojums reaģē ar skābekļa gāzi (O2. punkta g) apakšpunkts) katalizatora reģenerācijai. Zemāk skatiet, kā tas notiek, un novērojiet, kā viņi visi ir gāzes fāzē, veidojot viendabīgu vidi:
katalizatorskomplekss aktivizēts
1. darbība: 2 OS2. punkta g) apakšpunkts + 2 NĒ2. punkta g) apakšpunkts→ 2 OS3. punkta g) apakšpunkts + 2 NĒg)
2. darbība: 2 NĒg)+ 1 O2. punkta g) apakšpunkts → 2 NĒ2. punkta g) apakšpunkts
Globālā reakcija: 2 SO2. punkta g) apakšpunkts + O2. punkta g) apakšpunkts → 2 OS3. punkta g) apakšpunkts
Ņemiet vērā, ka katalizators piedalās tikai starpposmos, bet netiek patērēts. Reakcijas beigās viņš ir pilnībā atveseļojies. Reakcijai ar šo mehānismu, kas veikts divos posmos, nepieciešama mazāka aktivācijas enerģija, un tāpēc tā notiek ātrāk.
Grafiskais attēlojums:
Autore Jennifer Fogaça
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FOGAÇA, Jennifer Rocha Vargas. "Homogēna katalīze"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/catalise-homogenea.htm. Piekļuve 2021. gada 27. jūnijam.